Interacciones inusuales entre bacterias y células
En los libros de texto de biología, el retículo endoplásmico (RE) se presenta a menudo como un orgánulo compacto y distintivo, responsable del tráfico y secreción de proteínas. Sin embargo, en la práctica, el RE se extiende por toda la célula, estableciendo contactos y comunicación con otros orgánulos, lo que regula procesos tan variados como el metabolismo de grasas y azúcares, así como las respuestas inmunitarias.
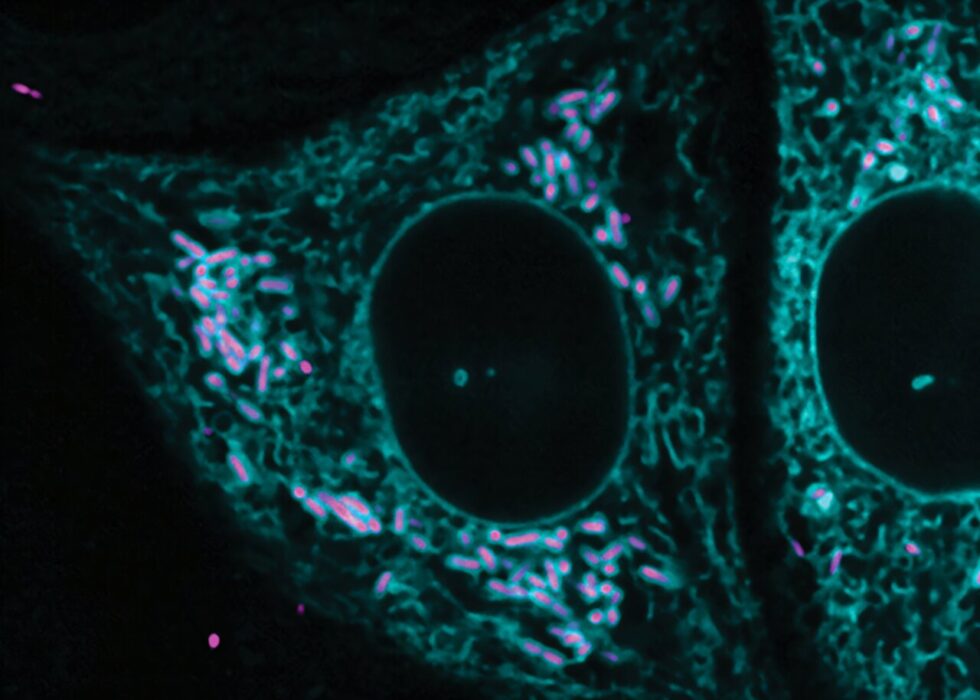
Un reciente estudio llevado a cabo por el Laboratorio Lamason del Departamento de Biología del MIT ha revelado que Rickettsia parkeri, un patógeno bacteriano que se desarrolla libremente en el citosol, puede interactuar de manera extensa y estable con el retículo endoplásmico rugoso, estableciendo contactos que nunca antes se habían observado. Este descubrimiento representa el primer ejemplo conocido de un sitio de contacto interreino directo entre un patógeno bacteriano intracelular y una membrana eucariota.
El laboratorio Lamason investiga R. parkeri como modelo para entender la infección causada por el más virulento Rickettsia rickettsii, que es transmitido por garrapatas y puede causar la fiebre manchada de las Montañas Rocosas. Si no se trata, esta infección puede llevar a síntomas graves, incluyendo la insuficiencia orgánica y la muerte.
Los hallazgos del estudio
Yamilex Acevedo-Sánchez, primera autora del estudio, se topó con estas interacciones mientras intentaba observar cómo Rickettsia alcanzaba uniones celulares. El modelo actual de infección sugiere que R. parkeri se propaga de célula a célula mediante el desplazamiento hacia sitios de contacto especializados entre células, donde es engullido por la célula vecina.
Sin embargo, en lugar de observar esto, Acevedo-Sánchez notó que un porcentaje inesperadamente alto de R. parkeri estaba rodeado y envuelto por el retículo endoplásmico a una distancia de aproximadamente 55 nanómetros. Este descubrimiento es significativo, ya que las membranas de contacto para la comunicación interorganelar en células eucariotas suelen tener un ancho de entre 10 y 80 nanómetros. Los investigadores descartaron que lo observado fuera una respuesta inmune, y confirmaron que las secciones del RE que interactuaban con R. parkeri seguían conectadas a la red más amplia del organelo.
Además, se constató que menos del 5% de R. parkeri formaban conexiones con el RE, pero se sabe que características en pequeñas cantidades son críticas para la infección. R. parkeri puede existir en dos estados: motil, con una cola de actina, y no motil, sin ella. En mutantes que no pueden formar colas de actina, R. parkeri no puede propagarse a células adyacentes, mientras que en no mutantes, el porcentaje de R. parkeri que tiene colas comienza en aproximadamente el 2% en las primeras fases de la infección y no supera el 15% en su punto máximo.
Las proteínas VAP, que median las interacciones del RE con otros orgánulos, fueron reclutadas hacia las bacterias durante la infección por R. parkeri. Cuando se eliminaron estas proteínas, la frecuencia de interacciones entre R. parkeri y el RE disminuyó, lo que sugiere que R. parkeri podría estar aprovechando estos mecanismos celulares para sus propios fines durante la infección.
Este trabajo, aunque aún en desarrollo, abre un camino hacia la comprensión de las interacciones que podrían influir en el ciclo de vida del huésped y del patógeno, así como su evolución. La investigación sobre R. parkeri podría ofrecer pistas sobre cómo los patógenos manipulan los procesos celulares esenciales para su supervivencia, lo que podría ser crucial para el desarrollo de nuevas opciones de tratamiento.






