La prostaglandina E2 (PGE2) es un lípido bioactivo derivado del ácido araquidónico que desempeña un papel crucial en una amplia gama de procesos fisiológicos mediante cuatro subtipos de receptores acoplados a proteínas G (GPCR): EP1 a EP4. A pesar de que las estructuras de alta resolución de los receptores EP2, EP3 y EP4 han sido determinadas, el receptor EP1 había permanecido sin caracterizar estructuralmente debido a su inestabilidad intrínseca, lo que ha dificultado una comprensión detallada de su señalización mediada por Gq.
Un estudio publicado en las Proceedings of the National Academy of Sciences por un equipo de investigación liderado por Eric H. Xu y Xu Youwei del Instituto de Materia Médica de la Academia China de Ciencias, ha revelado la estructura del receptor EP1 humano en complejos con PGE2 y la proteína G heterotrimérica Gq. Este avance completa el atlas estructural de la familia de receptores EP y desvela mecanismos específicos de reconocimiento de ligandos y transducción de señales del EP1.
Estrategias de Ingeniería y Resultados Estructurales
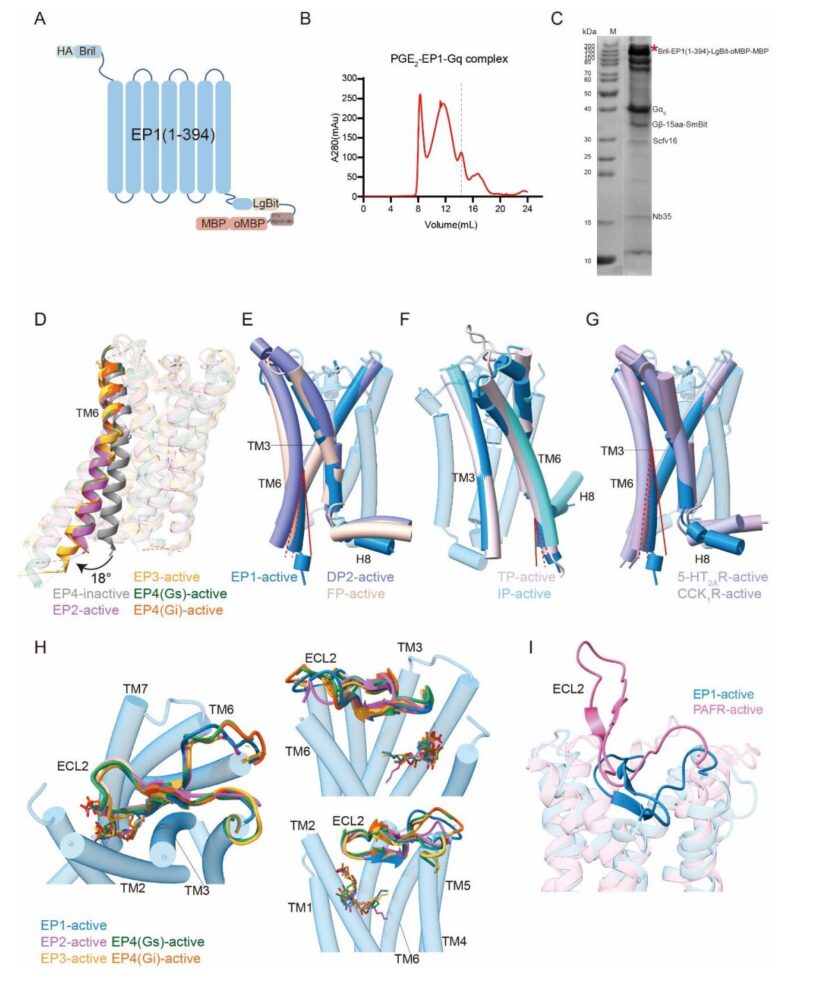
Para superar la inestabilidad del EP1, los investigadores emplearon una estrategia de ingeniería multifacética que incluyó la fusión con BRIL, la truncación de bucles flexibles, la incorporación de un quimera mini-Gq y la estabilización del complejo asistida por NanoBiT. Utilizando microscopía crioelectrónica (cryo-EM), lograron resolver la estructura del complejo EP1–PGE2–Gq a una resolución de 2.55 Å, lo que permite un análisis detallado de las interfaces de unión de ligandos y acoplamiento de proteínas G.
En sus observaciones, el equipo notó que la activación de EP1 inducía un ligero desplazamiento hacia afuera de la hélice transmembrana 6 (TM6) de aproximadamente 12°, un cambio notablemente menor en comparación con el desplazamiento de casi 18° observado en los receptores EP2 a EP4, lo que sugiere un mecanismo de activación específico de subtipos. Además, identificaron una constelación única de residuos (S421.42, H882.54, G922.58 y F3347.36) que formaban un motivo de unión distintivo para PGE2, ausente en otros receptores EP.
Los ensayos funcionales confirmaron que estos residuos son críticos para la activación inducida por ligandos. Resulta notable que el EP1 se aparta de los motivos canónicos de los GPCR de clase A: carece de la secuencia conservada DRY y presenta un cisteína inusual en la posición 3.51, lo que resalta aún más su perfil de señalización único.
En el lado intracelular, el receptor EP1 interactuó con la proteína Gq a través de interacciones tanto conservadas como específicas del receptor. Residuos como R63ICL1, E2946.32 y Q2986.36 contribuyeron a la orientación precisa de la hélice Gα5 dentro de la cavidad citoplasmática. Interacciones compensatorias adicionales, como las que involucran S692.35, parecieron estabilizar el acoplamiento de la proteína G, compensando por la falta de contactos encontrados en receptores relacionados como FP y TP.
Los hallazgos de este estudio no solo completan el marco estructural de la señalización de PGE2 a través de su familia de receptores, sino que también proporcionan una hoja de ruta para el desarrollo de terapias selectivas dirigidas al EP1. Dada la implicación del EP1 en el dolor, enfermedades cardiovasculares y ciertos tipos de cáncer, el diseño de fármacos basado en la estructura, informado por este estudio, posee un potencial translacional significativo.
Más información:
Xue Meng et al, Perspectivas estructurales sobre la activación del subtipo de receptor humano de prostaglandina E2 EP1 por prostaglandina E2, Proceedings of the National Academy of Sciences (2025). DOI: 10.1073/pnas.2423840122







