La investigación sobre las proteínas y su correcto plegamiento es fundamental para entender diversas enfermedades relacionadas con el mal funcionamiento celular. Un reciente estudio llevado a cabo por un equipo de químicos de la Universidad Estatal de Pensilvania ha revelado un mecanismo que explica por qué algunas proteínas, como la quinasa de fosfoglicerato (PGK), presentan un comportamiento de refolding inusual. Este hallazgo se publica en la revista Science Advances.
Mecanismos del Plegamiento Proteico
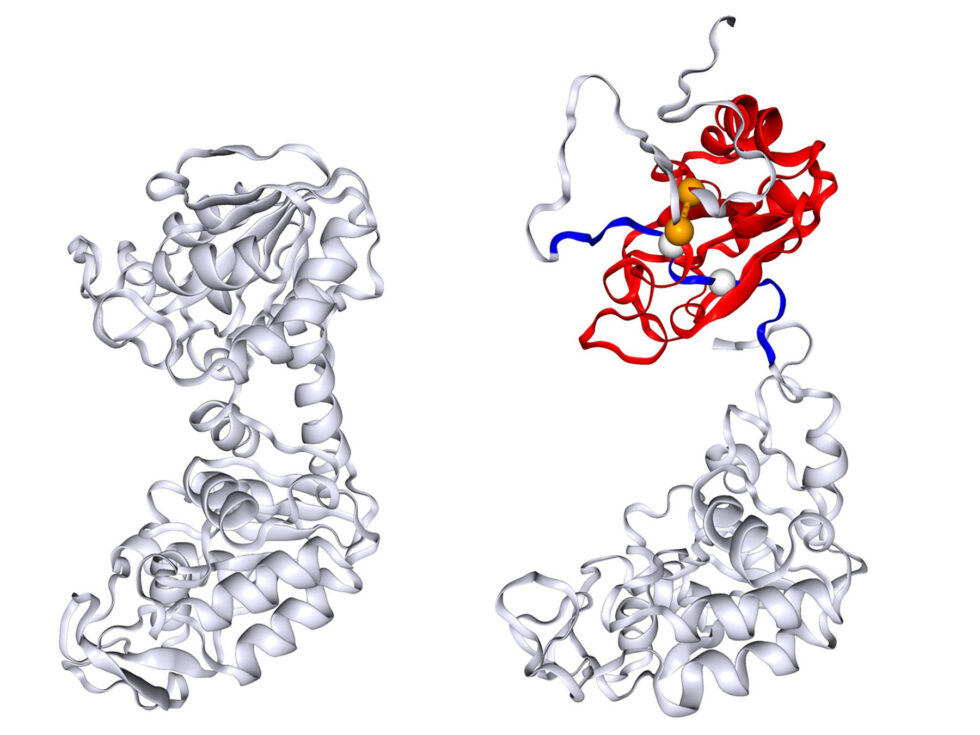
Las proteínas son moléculas largas que deben adoptar estructuras tridimensionales complejas para desempeñar sus funciones en las células. Sin embargo, este proceso de plegamiento no siempre ocurre de manera adecuada, lo que puede dar lugar a proteínas mal plegadas que, si no se corrigen, pueden contribuir a la aparición de diversas enfermedades. El estudio en cuestión ha identificado un tipo específico de mal plegamiento en el que las proteínas entrelazan incorrectamente sus segmentos, creando una barrera para el proceso de plegamiento normal. Esta situación requiere una alta inversión de energía o un desenredado extenso, lo que ralentiza el proceso de plegamiento y lleva a un patrón inesperado que fue observado por primera vez en la década de 1990.
El profesor Ed O’Brien, líder del equipo de investigación, destaca la importancia de comprender los mecanismos involucrados en el plegamiento de las proteínas, ya que esto podría ayudar a los investigadores a prevenir o desarrollar tratamientos para enfermedades causadas por el mal plegamiento. La investigación se centra en la PGK, cuya peculiaridad en el plegamiento fue identificada hace más de 25 años, desviándose del modelo tradicional de dos estados: plegado o desplegado.
El equipo de O’Brien formuló la hipótesis de que una clase recientemente identificada de mal plegamiento, denominada «entrelazamiento lasso no covalente», podría ser responsable de esta desviación en la PGK. Este fenómeno ocurre cuando un bucle de la proteína atrapa otro segmento, generando un entrelazado incorrecto. Los investigadores modelaron el proceso de plegamiento de la PGK mediante simulaciones informáticas, las cuales reprodujeron el comportamiento de refolding observado en experimentos previos.
Las simulaciones revelaron varios ejemplos de mal plegamiento que involucraban estos entrelazados. Al eliminar estos eventos de mal plegamiento, el equipo observó que la proteína se plegaba siguiendo el patrón exponencial típico de los modelos de dos estados. Para validar sus resultados, los investigadores también llevaron a cabo experimentos estructurales que confirmaron la existencia de los estados mal plegados previstos en las simulaciones.
La naturaleza de este tipo de mal plegamiento provoca que la proteína se «atasque», lo que requiere que retroceda en el proceso de plegamiento para corregir el error. Esto es tanto un proceso temporal como energéticamente costoso. Los descubrimientos de este estudio no solo amplían nuestro entendimiento sobre cómo se pliegan las proteínas, sino que también sientan las bases para el desarrollo de terapias para enfermedades asociadas al mal plegamiento proteico.
El equipo de investigación incluye a Yang Jiang, autor principal del estudio y profesor asistente de química, así como otros miembros de la Universidad Johns Hopkins. Este trabajo resalta la importancia de la investigación fundamental en la biología molecular y su potencial para influir en la medicina moderna.







