Un reciente estudio liderado por investigadores de la Universidad de Rice, Jeffrey Hartgerink y Tracy Yu, en colaboración con Mark Kreutzberger y Edward Egelman de la Universidad de Virginia, ha desafiado la comprensión tradicional sobre la estructura del colágeno, la proteína más abundante en el cuerpo humano. Publicado en la revista ACS Central Science, este trabajo sugiere que la diversidad estructural del colágeno podría ser mucho mayor de lo que se pensaba hasta ahora.
Utilizando técnicas avanzadas de microscopía crioelectrónica (cryo-EM), los investigadores han conseguido determinar la estructura atómica de un ensamblaje de colágeno empaquetado, que se desvía del giro superhélico derecho tradicionalmente aceptado. Hartgerink destaca que esta investigación modifica de manera fundamental la percepción que se tiene del colágeno, que durante décadas se asumió que seguía un paradigma estructural estricto.
Un nuevo enfoque sobre la conformación del colágeno
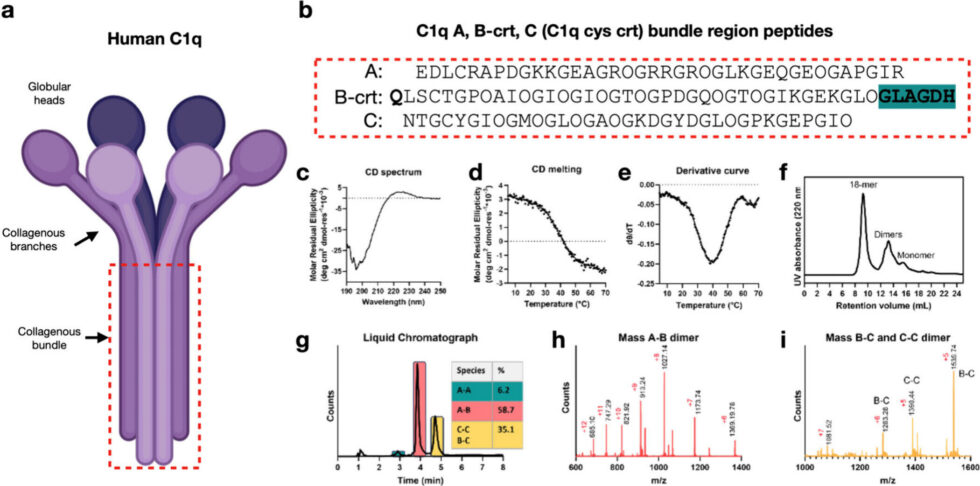
El equipo de investigación diseñó un sistema de péptidos autoensamblables basado en la región similar al colágeno de C1q, una proteína clave del sistema inmunológico. Al aplicar la tecnología cryo-EM, lograron analizar la estructura de los péptidos ensamblados, revelando una desviación del giro superhélico canónico. Esta nueva conformación permite interacciones moleculares únicas, como el apilamiento de hidroxiprolina entre hélices adyacentes y la formación de una cavidad hidrofóbica simétrica.
Yu, quien ahora es investigadora postdoctoral en la Universidad de Washington, señala que la ausencia del giro superhélico brinda la oportunidad de observar interacciones moleculares no vistas previamente en el colágeno. Kreutzberger, primer autor del estudio, afirma que estos hallazgos cuestionan creencias arraigadas y abren la puerta a la reevaluación de los roles biológicos del colágeno.
Las implicaciones de este descubrimiento pueden ir más allá de la biología fundamental. El colágeno no es solo una proteína estructural; desempeña roles esenciales en la señalización celular, la función inmunológica y la reparación de tejidos. Comprender mejor la variabilidad estructural del colágeno puede ofrecer nuevas perspectivas sobre enfermedades en las que se compromete su ensamblaje, como el síndrome de Ehlers-Danlos, la fibrosis y ciertos tipos de cáncer.
Además, este trabajo sienta las bases para innovaciones en biomateriales y medicina regenerativa. Al aprovechar las propiedades estructurales únicas de esta nueva conformación del colágeno, los científicos podrían diseñar materiales novedosos para la cicatrización de heridas, la ingeniería de tejidos y la entrega de fármacos.
A pesar de la ubicuidad del colágeno en la biología humana, el estudio de sus estructuras de orden superior a alta resolución ha sido un desafío. Las técnicas tradicionales, como la cristalografía de rayos X y la difracción de fibras, han proporcionado información valiosa, pero no han podido capturar el empaquetamiento del colágeno en ensamblajes complejos. La microscopía cryo-EM, sin embargo, ha superado estas limitaciones, permitiendo al equipo de investigación visualizar la intrincada arquitectura del colágeno con un nuevo nivel de detalle.
Egelman, coautor del estudio, enfatiza que esta investigación refina nuestra comprensión del colágeno y destaca la importancia de reevaluar otras estructuras biológicas que se pensaban bien comprendidas. Este avance no solo contribuye al campo de la biología estructural, sino que también abre nuevas avenidas para la investigación médica y el desarrollo de tratamientos innovadores.







