La exposición a radiaciones ultravioleta (UV), el humo del tabaco y otros carcinógenos tiene efectos perjudiciales evidentes, como las quemaduras solares y el envejecimiento de la piel. Sin embargo, las consecuencias de estos agentes nocivos van más allá de la superficie, provocando daños en el ADN que, a menudo, pasan desapercibidos. Comprender cómo el organismo repara y protege su material genético es fundamental para el tratamiento de trastornos genéticos y enfermedades mortales como el cáncer. A pesar de los avances en la investigación médica, muchos mecanismos moleculares de reparación del ADN siguen siendo un enigma.
Investigadores de la Universidad Estatal de Georgia han recurrido al superordenador Summit, ubicado en el Laboratorio Nacional de Oak Ridge del Departamento de Energía de EE. UU., para estudiar un complejo y vital proceso molecular conocido como reparación por escisión de nucleótidos (NER, por sus siglas en inglés). Este proceso se basa en una serie de complejos proteicos altamente dinámicos que excisan el ADN dañado con precisión quirúrgica.
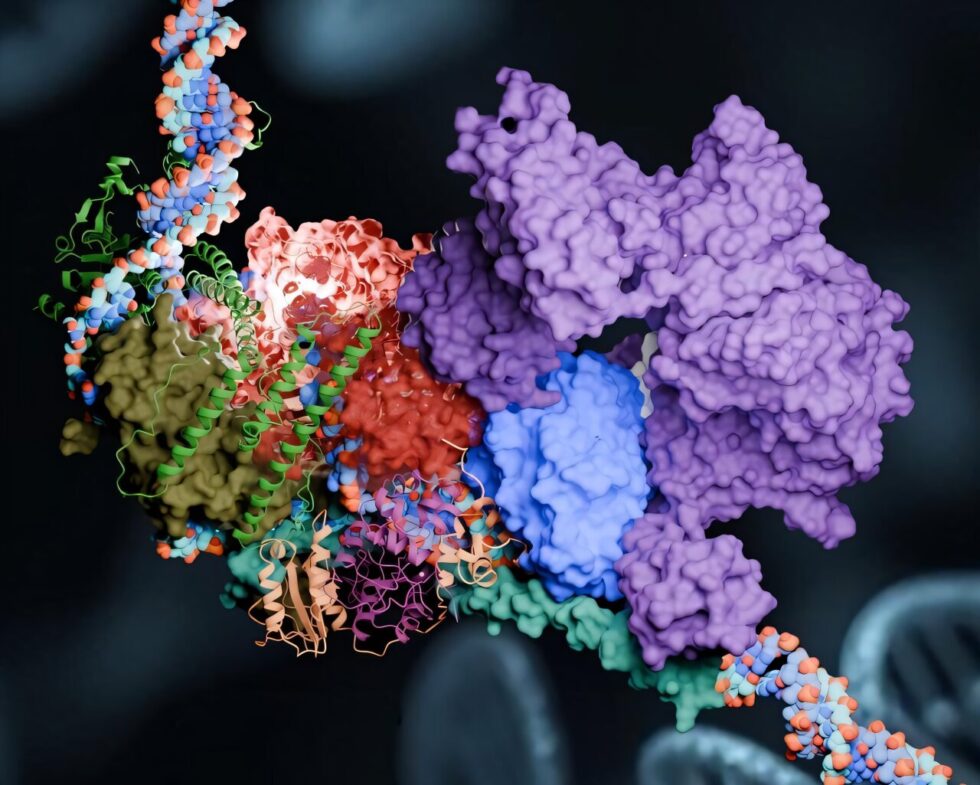
En un estudio reciente, publicado en Nature Communications, el equipo ha desarrollado un modelo computacional de un componente crítico del NER, denominado complejo preincisión (PInC). Este complejo desempeña un papel clave en la regulación de los procesos de reparación del ADN en las etapas finales de la vía NER. Desentrañar la secuencia sofisticada de eventos de NER y el papel del PInC podría proporcionar información crucial para desarrollar tratamientos novedosos y prevenir condiciones que llevan al envejecimiento prematuro y a ciertos tipos de cáncer.
Las tres etapas de la reparación
El NER se desenvuelve en tres etapas distintas: reconocimiento, verificación y reparación. Cada etapa requiere grupos específicos de proteínas que realizan funciones concretas, similar a cómo un equipo médico tiene diferentes especialistas para tratar a pacientes heridos en una sala de emergencias. De este modo, la maquinaria del NER puede adaptarse y cambiar su forma según la tarea que tenga entre manos.
En la primera etapa, la proteína NER llamada XPC (grupo C de xeroderma pigmentoso) actúa como un primer respondedor, localizando el sitio del ADN dañado y torciendo la hélice de ADN para hacer accesible el daño. Posteriormente, XPC convoca a otras proteínas reparadoras para iniciar la segunda etapa, conocida como verificación del daño.
En esta fase, la maquinaria proteica del NER cambia de forma. Mientras XPC se retira, el complejo proteico conocido como factor de transcripción IIH (TFIIH) se posiciona. TFIIH desenreda aún más la sección de ADN y escanea la cadena recién expuesta en busca de lesiones. Finalmente, en la tercera etapa de la reparación, es el PInC quien asume el control.
Con el «paciente» estabilizado y preparado para la cirugía, se inicia la operación para eliminar la cadena de ADN dañada. Dos enzimas, XPF y XPG, se posicionan perfectamente a cada lado de la lesión y actúan como tijeras moleculares para cortar el segmento dañado de ADN. Tras la excisión, se sintetiza nuevo ADN para llenar el hueco dejado atrás, y finalmente, la estructura del ADN se sella, restaurando la salud del material genético.
La comprensión de cómo se forma el PInC tras la fase de escaneo de lesiones es fundamental, ya que influye en la correcta posicionamiento de las enzimas que realizan la incisión dual de la cadena de ADN dañada. Las mutaciones en las proteínas XPF y XPG pueden dar lugar a trastornos genéticos severos, como el xeroderma pigmentoso, que aumenta la susceptibilidad al cáncer de piel, y el síndrome de Cockayne, que afecta al crecimiento y desarrollo humano y acelera el proceso de envejecimiento.
Para abordar estas cuestiones, los investigadores utilizaron un modelo basado en redes neuronales llamado AlphaFold2 para predecir las estructuras desconocidas y las interfaces entre las proteínas que mantienen unido al PInC. Gracias al poder de cálculo del Summit, que puede realizar 200,000 billones de cálculos por segundo, se llevaron a cabo simulaciones extensivas que desvelaron la dinámica funcional del complejo PInC en escalas de tiempo de microsegundos.
Las simulaciones revelaron la complejidad de la maquinaria del PInC, mostrando cómo sus diferentes componentes se mueven en conjunto como módulos, y cómo se subdivide en comunidades dinámicas que forman las partes móviles de esta máquina molecular. Con esta investigación, los científicos han logrado una comprensión más profunda de cómo y desde dónde se manifiestan estos trastornos, lo que abre nuevas vías para la investigación y el tratamiento de enfermedades relacionadas con el ADN.







