
En los organismos vivos, cada proteína, un tipo de polímero biológico compuesto por cientos de aminoácidos, realiza funciones específicas como la catálisis, el transporte de moléculas o la reparación del ADN. Para llevar a cabo estas funciones, deben plegarse en formas específicas. Este proceso, complejo y crítico para la vida, sigue siendo objeto de numerosas preguntas sin respuesta a pesar de los avances en el campo.
Un estudio publicado en PRX Life aporta algunas respuestas a esta problemática y podría abrir nuevas vías para el diseño de proteínas en terapias farmacológicas, biomateriales novedosos y otras aplicaciones. Los investigadores, liderados por Corey O’Hern, desarrollaron modelos computacionales para todas las proteínas globulares en la base de datos Protein Data Bank y midieron las regiones internas de sus núcleos para determinar su densidad de empaquetamiento.
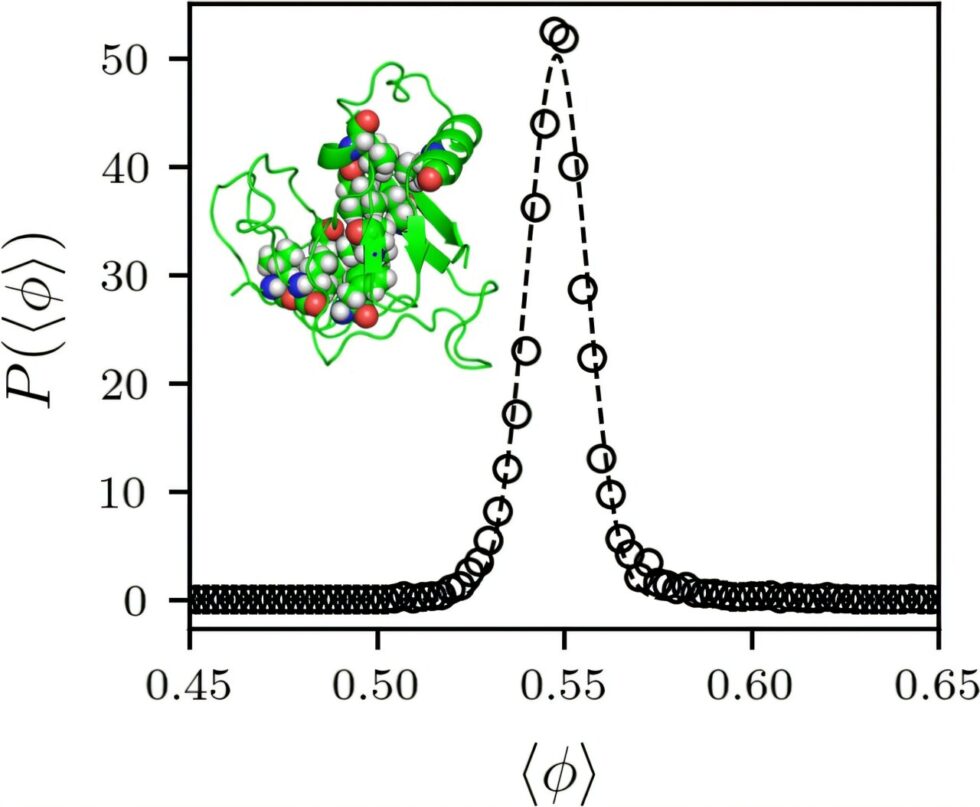
Los resultados mostraron que cada proteína tenía un porcentaje de empaquetamiento en su núcleo del 55%, lo que significa que el 55% del espacio estaba ocupado por átomos. Esto llevó al equipo de investigación a plantear dos preguntas clave: «¿Por qué todas tienen el mismo valor? Y, específicamente, ¿por qué el valor es del 55%?» O’Hern, profesor de ingeniería mecánica, ciencia de materiales, física y física aplicada, explicó que la respuesta parece radicar en que el porcentaje de empaquetamiento deja de aumentar cuando los núcleos de las proteínas se compactan o rigidifican.
Es decir, los aminoácidos que componen el núcleo de la proteína no podían comprimir más cuando la proteína se plegaba. El porcentaje de empaquetamiento en el que los objetos se amontonan depende en gran medida de su forma. Por ejemplo, los objetos esféricos se amontonan a un porcentaje de empaquetamiento del 64%. Sin embargo, los aminoácidos tienen formas complejas, la mayoría de ellos son alargados y rugosos debido a los átomos de hidrógeno unidos.
El estudio también abre un camino interesante sobre si el porcentaje de empaquetamiento del núcleo de las proteínas puede ser más denso de lo que se encuentra en condiciones fisiológicas. Investigaciones previas sobre proteínas a altas presiones, que imitan las condiciones en los respiraderos hidrotermales de las profundidades oceánicas, sugieren que el empaquetamiento puede aumentar hasta un 58-60%. Esta investigación está relacionada también con nuestra comprensión de los orígenes de la vida.
Alex Grigas, candidato a doctorado en el laboratorio de O’Hern y autor principal del artículo, señaló que ahora que se conocen las propiedades de los núcleos de proteínas en condiciones típicas de plegamiento, es posible que no se necesite detener el empaquetamiento en el 55%. «Si cambias las condiciones del disolvente, la presión o la temperatura, puedes hacer que los aminoácidos se empaquen de manera más eficiente», añadió.
O’Hern enfatizó que el diseño de proteínas actualmente se centra en la creación de nuevas secuencias de aminoácidos para ingenierizar nuevas estructuras y funciones proteicas. «Este trabajo abre la posibilidad de que, incluso con la misma secuencia de aminoácidos, se puedan diseñar nuevas estructuras y funciones proteicas simplemente cambiando las condiciones de plegamiento», concluyó.
Más información:
Alex T. Grigas et al, «Protein Folding as a Jamming Transition», PRX Life (2025). DOI: 10.1103/PRXLife.3.013018
Proporcionado por
Yale University