Los leucotrienos cisteinilicos (CysLTs) son potentes broncoconstrictores que desempeñan un papel crucial en diversas enfermedades inflamatorias. Estos mediadores lipídicos actúan activando receptores acoplados a proteínas G, específicamente el CysLT1R y el CysLT2R. Mientras que el CysLT1R tiene una función predominante en los pulmones, el CysLT2R se encuentra en múltiples sistemas orgánicos, lo que sugiere su implicación en trastornos cardiovasculares y neurológicos.
La amplia distribución del CysLT2R lo posiciona como amplificador de la inflamación local y como un puente para enfermedades sistémicas. Sin embargo, la conformación del receptor CysLT2R activado al unirse a un ligando endógeno aún no se ha esclarecido. Las dificultades en el descubrimiento de fármacos, caracterizadas por puntos ciegos en el cribado y una baja tasa de éxito en la identificación de posibles tratamientos, han obstaculizado el tratamiento de enfermedades relacionadas con el CysLT2R.
Avances en la comprensión del CysLT2R
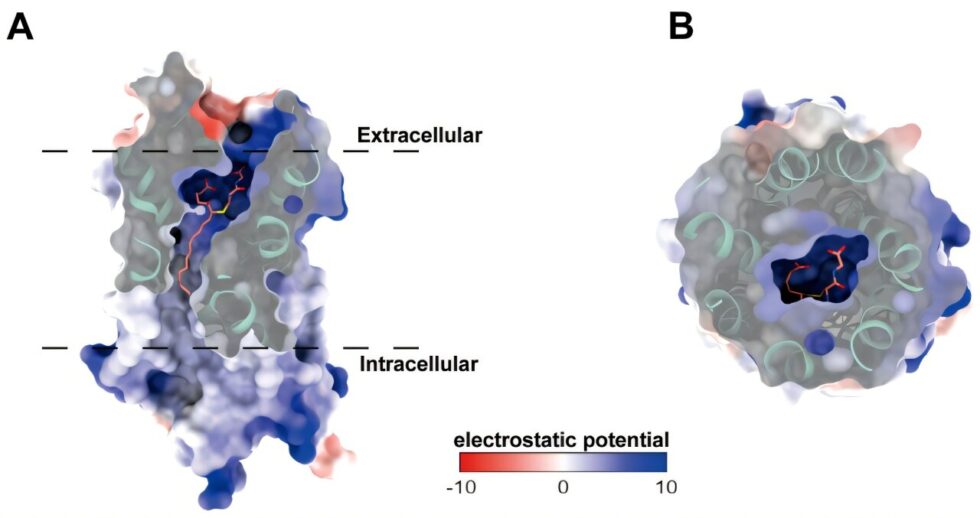
Un estudio publicado en la revista Proceedings of the National Academy of Sciences el 7 de abril, liderado por Yin Wanchao del Instituto de Materia Médica de Shanghái, junto a Jiang Yi del Laboratorio Lingang y Zhang Shuyang del Colegio Médico de la Unión de Pekín, ha logrado obtener una estructura de alta resolución del CysLT2R en unión con el ligando endógeno leucotrieno D4 (LTD4). Esta estructura muestra una conformación activada con una resolución de 3.15 Å, revelando que el CysLT2R se une a LTD4 para reclutar la proteína Gαq en la señalización celular.
Utilizando la criomicroscopía electrónica de partículas individuales, los investigadores hicieron varios descubrimientos significativos. Se observó que el LTD4 puede ingresar al bolsillo de unión a través de un canal transverso vertical entre las hélices de los dominios transmembrana (TM) 4 y 5. La cabeza polar de LTD4 se ancla de manera segura mediante una compleja red de enlaces de hidrógeno con el segundo lazo extracelular del receptor y las hélices transmembrana.
Por el contrario, la cola alquilo de LTD4 interactúa de manera hidrofóbica con el receptor, estabilizando el bolsillo de unión del ligando. Este mecanismo dual de «enlaces de hidrógeno en la parte superior, y bloqueo hidrofóbico en la parte inferior» pone de manifiesto la conservación evolutiva en los receptores acoplados a proteínas G que se unen a lípidos. Además, los investigadores revelaron que la hélice TM3 desempeña un papel crítico en la inducción de agonistas y en la activación del receptor. Cuando el leucotrieno D4 se une al CysLT2R, desencadena un cambio conformacional en TM3, transformando el receptor en su forma activa y liberando una cascada de eventos de señalización a nivel celular.
Interesantemente, en su estado inactivo, tanto el CysLT1R como el CysLT2R exhiben conformaciones casi idénticas de TM3, sugiriendo un «plano de activación» universal para toda la familia de receptores CysLTR. Este estudio avanza en la comprensión de cómo el CysLT2R es activado por su ligando endógeno LTD4, lo que facilitará el diseño de fármacos antiinflamatorios y antialérgicos basados en la estructura, mejorando potencialmente el tratamiento de enfermedades asociadas con la desregulación de la vía de los leucotrienos.
Las enfermedades cardiovasculares, los trastornos psiquiátricos y ciertos tipos de cáncer podrían beneficiarse de terapias dirigidas que bloqueen el CysLT2R, ofreciendo nuevas esperanzas para los pacientes que sufren estas condiciones debilitantes.
Más información:
Mengting Jiang et al, Base estructural de la activación del receptor de leucotrienos cisteinilicos tipo 2 por LTD4, Proceedings of the National Academy of Sciences (2025). DOI: 10.1073/pnas.2417148122







