El proceso de metabolización de los fármacos es esencial para su eficacia en el tratamiento de distintas enfermedades. Sin embargo, el sistema enzimático conocido como citocromo P450 (CYP) puede descomponer más del 80% de los medicamentos aprobados por la FDA, lo que puede reducir su efectividad. Investigadores del St. Jude Children’s Research Hospital han realizado avances significativos al desarrollar nuevos marcos moleculares que permiten una inhibición selectiva de CYP3A4, una de las proteínas CYP más relevantes en este contexto. Los resultados de este estudio han sido publicados en Nature Communications.
CYP3A4 es responsable de metabolizar medicamentos utilizados para tratar diversas condiciones de salud, incluyendo el paclitaxel, un agente antitumoral, y el nirmatrelvir, un tratamiento para el COVID-19. Para contrarrestar la acción de CYP3A4, se suelen administrar inhibidores, como el ritonavir, que se combina con nirmatrelvir en el tratamiento de COVID-19 leve. Sin embargo, estos inhibidores no son selectivos y también pueden afectar a CYP3A5, lo que provoca interacciones indeseadas con otros fármacos y potencialmente peligrosos efectos secundarios.
Avances en la selectividad de los inhibidores
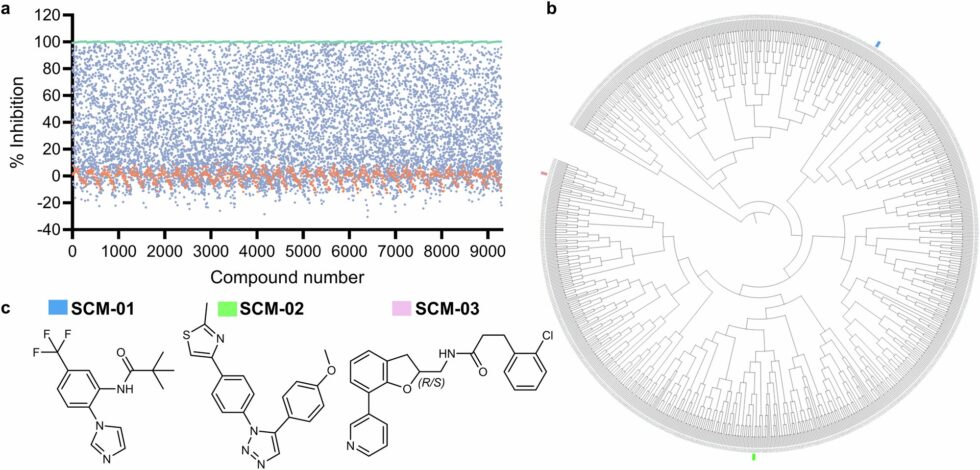
Los investigadores llevaron a cabo un cribado de alta capacidad que redujo un total de 9,299 compuestos candidatos a un panel de tres estructuras que lograron una inhibición selectiva y potente de CYP3A4. Utilizando técnicas de cristalografía de rayos X, se identificó una diferencia clave entre CYP3A4 y CYP3A5: una estructura en forma de bucle en la terminal C de CYP3A5 actúa como una barrera física que dificulta la unión de los inhibidores destinados a CYP3A4.
Gracias a esta información, los investigadores optimizaron la estructura de los inhibidores para maximizar tanto la selectividad como la potencia. Uno de los inhibidores optimizados, denominado SCM-08, mostró una diferencia de 46 veces en la inhibición de CYP3A4 en comparación con CYP3A5 y evitó la unión a otras proteínas CYP que suelen ser blanco de los inhibidores existentes. Este hallazgo podría ser un punto de partida crucial para diseñar inhibidores de CYP3A4 aún más selectivos.
El Dr. Taosheng Chen, autor principal del estudio, expresó que el objetivo es mejorar la potencia mientras se mantiene la selectividad de los inhibidores de CYP3A4. “Estos compuestos son los puntos de partida para lograrlo, ahora factible gracias a la base estructural de selectividad que hemos descubierto”, señaló.
Este avance no solo podría aumentar la eficacia de los tratamientos actuales, sino también reducir el riesgo de efectos adversos relacionados con la interacción de medicamentos, una cuestión crítica en la práctica médica contemporánea. La investigación marca un paso importante en el desarrollo de fármacos más seguros y eficaces, lo que es particularmente relevante en un contexto donde la medicina personalizada y la farmacogenómica están cobrando cada vez más protagonismo.
Más información:
Jingheng Wang et al, Decoding the selective chemical modulation of CYP3A4, Nature Communications (2025). DOI: 10.1038/s41467-025-58749-8