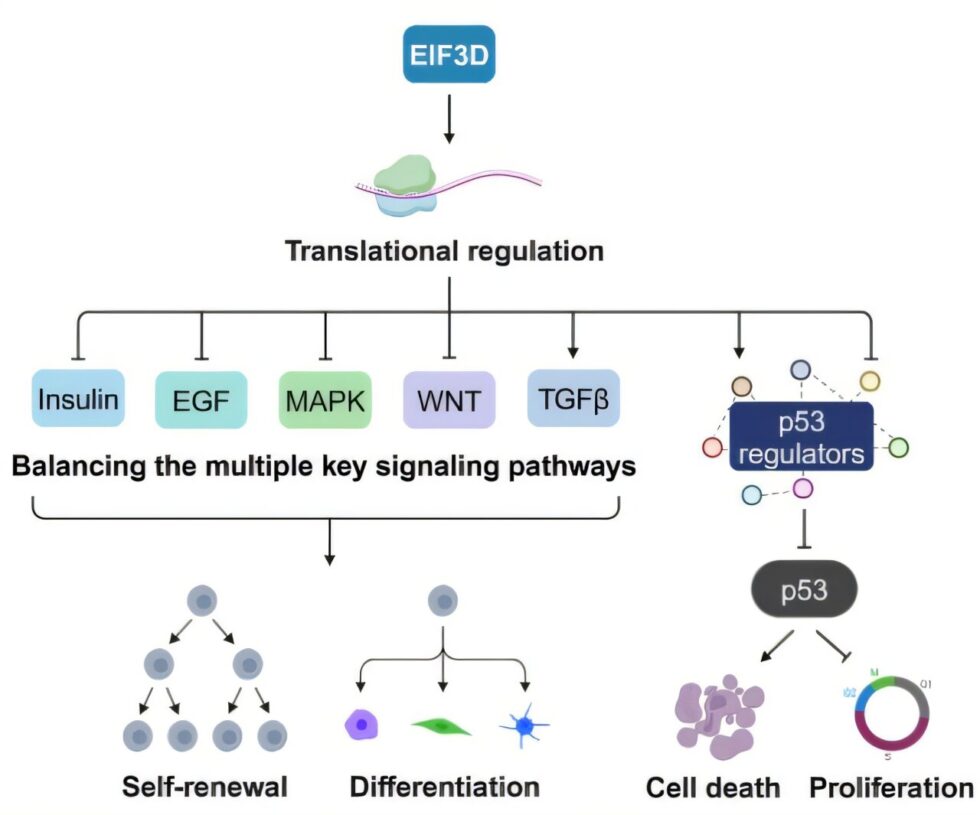
 Representación esquemática del modelo que describe cómo la regulación de la traducción mediada por EIF3D equilibra la homeostasis de las vías de señalización críticas en la pluripotencia primada. Crédito: Science Advances (2025). DOI: 10.1126/sciadv.adq5484
Representación esquemática del modelo que describe cómo la regulación de la traducción mediada por EIF3D equilibra la homeostasis de las vías de señalización críticas en la pluripotencia primada. Crédito: Science Advances (2025). DOI: 10.1126/sciadv.adq5484
Investigadores del Centro de Investigación de Células Inducidas a Pluripotencia (CiRA) han descubierto el papel crucial de EIF3D, un regulador de la traducción de proteínas, en la pluripotencia primada. Este trabajo ha sido publicado en la revista Science Advances.
Según el dogma central de la biología molecular, la información fluye del ADN al ARN y de este a las proteínas. Aunque se ha avanzado considerablemente en la comprensión de la pluripotencia —la capacidad de diferenciarse en cualquier otro tipo celular y dividirse indefinidamente— en términos de regulación transcripcional, epigenética y de transducción de señales, la conexión entre la traducción de proteínas y estos mecanismos de control ha sido poco explorada.
Para identificar los genes que son importantes para mantener la pluripotencia primada —un estado preparado para diferenciarse en varios tipos celulares— el equipo de investigación, liderado por el profesor asociado Kazutoshi Takahashi y la profesora asistente Chikako Okubo, realizó una pantalla genética a nivel genómico basada en la interferencia CRISPR (CRISPRi), que reduce sistemáticamente la expresión de cada gen en el genoma de una línea celular de células madre pluripotentes (PSC).
Al monitorear un marcador estándar de células no diferenciadas en diferentes momentos tras la inhibición de la expresión génica, los investigadores pudieron determinar si un gen específico regula positiva o negativamente la pluripotencia.
Entre sus hallazgos, los investigadores descubrieron que los genes asociados con la traducción de proteínas influyen de manera significativa en la pluripotencia. En particular, se centraron en EIF3D, cuya reducción drástica en las células generó una disminución de la pluripotencia primada y que pertenece a la familia EIF3, que interactúa con EIF4G2, un regulador de la traducción conocido por mantener la pluripotencia primada.
Utilizando una línea celular de células madre pluripotentes inducidas (iPS) con expresión de EIF3D suprimida, los investigadores también observaron cambios morfológicos y defectos de crecimiento. Un análisis adicional mostró que estas células presentaban una disminución en la expresión de factores de transcripción que promueven la pluripotencia.
Por el contrario, los objetivos transcripcionales de p53 —un regulador del ciclo celular frecuentemente mutado en cánceres— como CDKN1A y MDM2, se encontraron sobreexpresados en estas células. Además, se indujeron marcadores de estrés celular y senescencia.
De manera notable, la expresión proteica de p53 se incrementó significativamente en las células con expresión de EIF3D suprimida, a pesar de que no se observó un cambio en la expresión a nivel de ARN, lo que sugiere que la reducción de EIF3D lleva a una desregulación translacional de p53.
Para investigar más a fondo el papel de EIF3D en la preservación de la pluripotencia, el equipo examinó el perfil de expresión génica de las células con expresión de EIF3D suprimida, así como de células con factores de transcripción de pluripotencia central suprimidos y células diferenciadas en las tres principales capas germinales.
Las células con EIF3D reducido mostraron una falta de expresión de marcadores relacionados con las PSC primadas o células de línea germinal, asumiendo así un estado diferente al de las otras células en comparación.
Cuando el equipo examinó específicamente los ARN mensajeros (ARNm) que se traducían en células con expresión de EIF3D suprimida, determinaron que EIF3D está involucrado en dirigir la unión de la maquinaria de traducción de proteínas a ciertos ARNm en las PSC primadas.
Además, muchos genes asociados con la pluripotencia se encontraban desregulados en su ausencia, lo que afecta múltiples cascadas de señalización, incluida la vía de p53, que regula la pluripotencia primada.
Este trabajo revela el papel crítico de EIF3D en la salvaguarda de la pluripotencia primada, además de resaltar el impacto de la regulación translacional en este proceso fundamental. Al mejorar nuestra comprensión de los factores que controlan la pluripotencia, este descubrimiento impulsa tanto el estudio básico de las células madre como su aplicación práctica para la medicina del futuro.
Más información:
Chikako Okubo et al, EIF3D safeguards the homeostasis of key signaling pathways in human primed pluripotency, Science Advances (2025). DOI: 10.1126/sciadv.adq5484
Proporcionado por
Kyoto University