Durante miles de millones de años, los virus y las bacterias han estado inmersos en una carrera armamentista. A medida que las bacterias evolucionan nuevas formas de defenderse contra los virus, conocidos como bacteriófagos o «phages», estos últimos también desarrollan estrategias para superar esas defensas. Un reciente estudio publicado en Molecular Cell por científicos de los Institutos Gladstone y de la Universidad de California en San Francisco (UCSF) ha revelado detalles sobre una respuesta inesperada de ciertas células bacterianas: la auto-destrucción. Estos hallazgos podrían ser útiles para el desarrollo de nuevos antibióticos o tratamientos para infecciones resistentes a los medicamentos.
El estudio se centra en el sistema de defensa antiviral más común en las bacterias, conocido como el sistema de «restricción-modificación». Este sistema detecta el ADN de un fago invasor y lo corta en fragmentos antes de que el fago pueda apoderarse de la célula. Sin embargo, algunos fags han desarrollado contramedidas que inhiben este sistema, permitiéndoles infiltrarse. Los científicos observaron que, si las células bacterianas detectan esta contradefensa, desencadenan su propia muerte utilizando componentes del mismo sistema que los fags intentaban inhibir.
Defensas evolutivas y sacrificio celular
El Dr. Sukrit Silas, investigador en Gladstone y autor principal del estudio, explica que esta respuesta puede interpretarse como una fusión de las primeras y segundas líneas de defensa. «Se podría decir que es el sistema inmunológico bacteriano decidiendo que la infección ha ido demasiado lejos y, altruistamente, iniciando su propia destrucción o letargo para evitar que el fago se replique. Esto protege a las células bacterianas vecinas de ser infectadas», señala Silas.
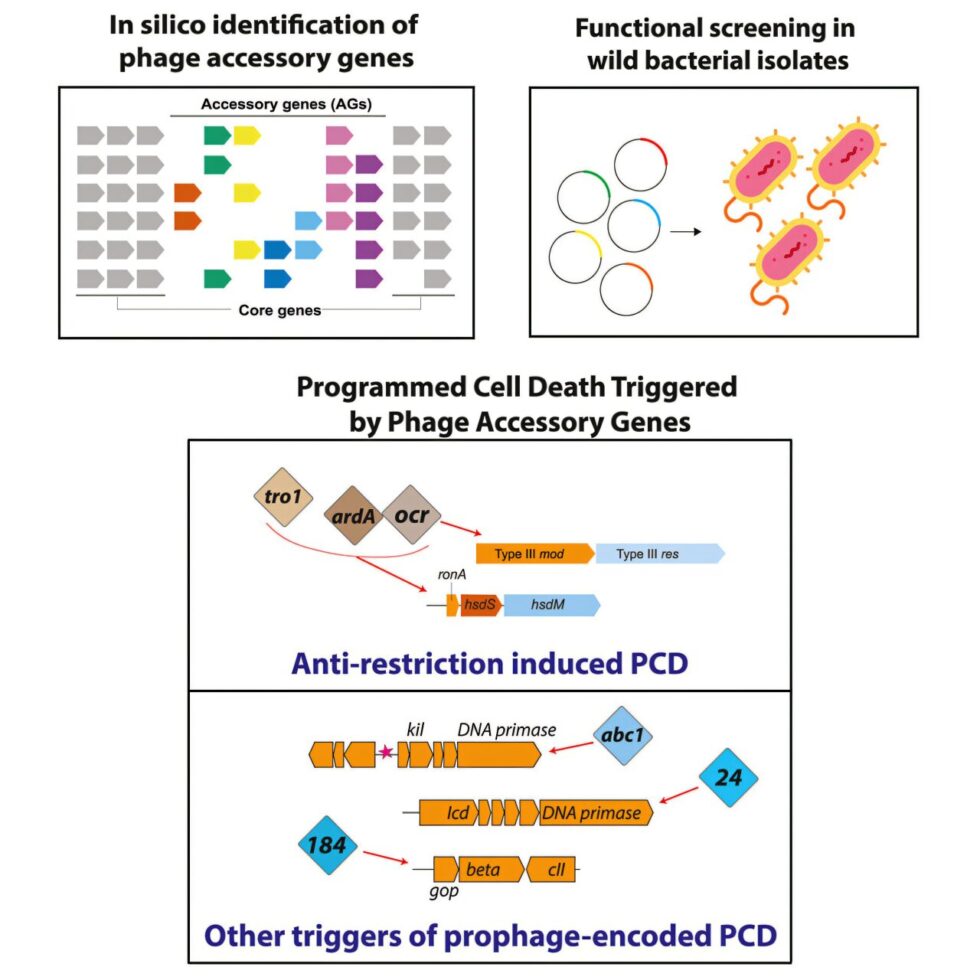
La investigación se centró en regiones accesorias poco exploradas de los genomas de los fags. Los genes en estas regiones no son siempre esenciales para la supervivencia del fago, pero pueden ser necesarios en ciertas circunstancias, como ayudar a evadir la detección por parte de los sistemas inmunitarios bacterianos. Silas y su equipo identificaron más de 10,000 nuevos genes accesorios en más de 1,000 genomas de fags que infectan bacterias de la familia Enterobacteria, incluyendo E. coli.
Algunos de estos genes accesorios neutralizaron los sistemas de restricción-modificación bacterianos, permitiendo que los fags infectaran las células. Sin embargo, otros genes provocaron que algunas cepas de E. coli se autodestruyeran. Los investigadores encontraron que múltiples genes accesorios de diferentes fags pueden activar el mismo camino para iniciar la muerte celular. Al investigar qué defensas bacterianas eran responsables de esta auto-destrucción, se sorprendieron al encontrar que eran sistemas derivados del propio sistema de restricción-modificación bacteriano.
Este estudio expande nuestra comprensión de la carrera evolutiva entre bacterias y fags. Según el Dr. Joe Bondy-Denomy, co-líder del estudio, estas respuestas de muerte celular parecen ser trampas evolutivas para los fags: tener estos genes accesorios puede arriesgar la muerte de las células que intentan infectar, aunque perder los mismos genes podría hacer a los fags vulnerables a la destrucción de su propio ADN.
La plataforma de investigación desarrollada en este estudio podría acelerar la comprensión de miles de genes accesorios adicionales en fags que infectan una amplia gama de especies microbianas. Al iluminar tácticas específicas, vulnerabilidades y tendencias en la carrera armamentista entre bacterias y fags, esta investigación podría informar los esfuerzos para diseñar nuevos tratamientos antimicrobianos y combatir las bacterias resistentes a los medicamentos.
Como señala Silas, «no solo estoy preguntando qué hacen estos genes, sino utilizando esa información para centrarme en lo que más importa para ciertos fags y bacterias, y qué necesitamos entender para diseñar un tratamiento novedoso que podría llegar a un ensayo clínico».