Las enfermedades mitocondriales afectan aproximadamente a 1 de cada 5,000 personas en el mundo, causando síntomas debilitantes que varían desde debilidad muscular hasta episodios similares a un accidente cerebrovascular. Algunas de estas condiciones son consecuencia de mutaciones en el ADN mitocondrial (mtDNA), que es el material genético que se encuentra en estos orgánulos. Para aquellos pacientes con la mutación común m.3243A>G, que puede provocar el síndrome MELAS (miopatía mitocondrial, encefalopatía, acidosis láctica y episodios similares a un accidente cerebrovascular) y diabetes mellitus, las opciones de tratamiento continúan siendo limitadas.
Un reto fundamental en la investigación de enfermedades mitocondriales es que los pacientes suelen presentar una mezcla de ADN mitocondrial normal y mutado dentro de sus células. Esta condición, conocida como heteroplasmia, dificulta el desarrollo de terapias específicas, ya que las proporciones de ADN mitocondrial normal a mutado pueden variar significativamente de un tejido a otro.
Avances en la manipulación del ADN mitocondrial
Además, la investigación básica actual sobre mutaciones en el mtDNA enfrenta obstáculos significativos que surgen de la falta de modelos de enfermedad. La compleja relación entre la carga de mutación (el porcentaje de mtDNA mutado) y la gravedad de la enfermedad sigue siendo poco comprendida, en parte porque no existen herramientas para manipular con precisión los niveles de heteroplasmia en ninguna dirección. Sin la capacidad de crear modelos celulares con diferentes cargas de mutación, los científicos no pueden estudiar de manera efectiva cómo los porcentajes variables de mtDNA mutado se relacionan con la manifestación de la enfermedad.
Ante este panorama, un equipo de investigación liderado por el profesor asistente Naoki Yahata, del Departamento de Biología del Desarrollo de la Universidad de Salud Fujita en Japón, ha desarrollado una tecnología que puede modificar los niveles de heteroplasmia en células cultivadas que presentan la mutación m.3243A>G. Su estudio, publicado en la revista Molecular Therapy Nucleic Acids, detalla la ingeniería y uso de nucleasas de tipo TALEN (nucleasas de activadores de transcripción) dirigidas al mtDNA, optimizadas para este propósito.
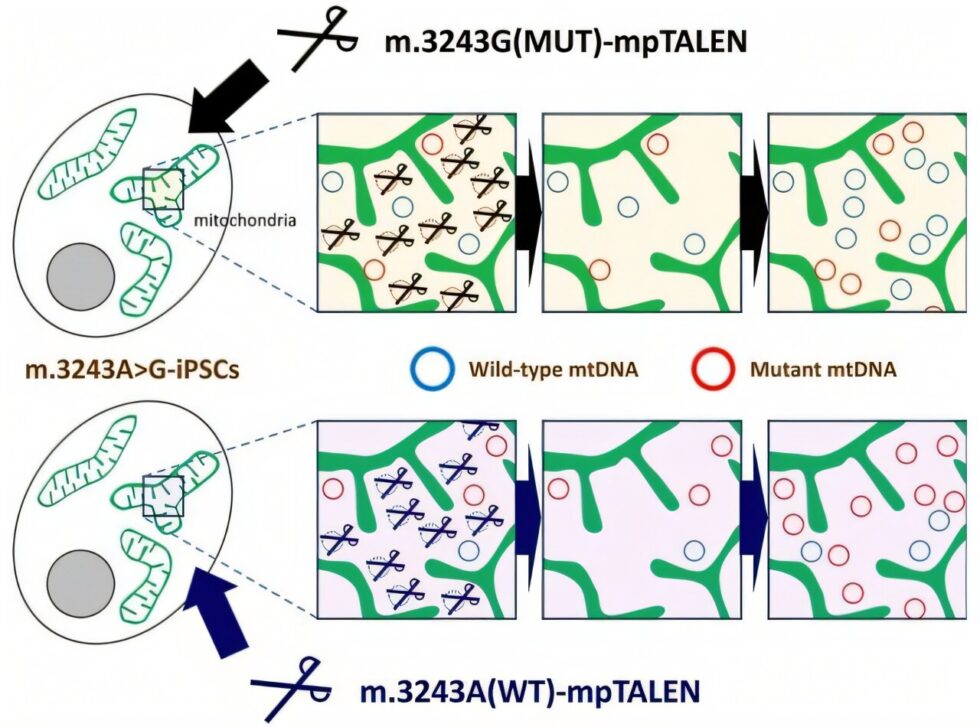
Los investigadores primero establecieron cultivos de células madre pluripotentes inducidas (iPSCs) derivadas de pacientes que contienen la mutación m.3243A>G y luego diseñaron dos versiones de su sistema mpTALEN: una que destruye el mtDNA mutado y otra que ataca el mtDNA normal. Este enfoque bidireccional les permitió generar células con cargas de mutación que variaban desde tan solo un 11% hasta un 97%, manteniendo al mismo tiempo la capacidad de las células para diferenciarse en varios tipos de tejidos.
El Dr. Yahata señala: «Nuestro estudio es el primero en demostrar un aumento en la proporción de mtDNA mutado patogénico mediante nucleasas programables». Entre las innovaciones clave de su enfoque se incluyen el uso de novedosos residuos variables de repetición no convencionales y dominios de nucleasas heterodiméricas FokI, que mejoraron la especificidad de la tecnología y redujeron la degradación no deseada del mtDNA fuera del objetivo. El equipo también empleó técnicas adicionales, como la suplementación con uridina, para establecer líneas celulares estables con diferentes cargas de mutación, incluso aquellas que típicamente podrían tener una desventaja en su crecimiento.
Los resultados del estudio representan un avance significativo en la medicina mitocondrial. En primer lugar, proporciona a los investigadores múltiples líneas celulares isogénicas—genéticamente idénticas—que difieren únicamente en su nivel de heteroplasmia. Esto permite un estudio preciso de cómo la carga de mutación afecta la manifestación de la enfermedad. En segundo lugar, sugiere que la tecnología mpTALEN podría tener un valor terapéutico en la reducción de la carga de mtDNA mutado en pacientes.
El Dr. Yahata concluye: «Nuestro método propuesto podría adaptarse a otros mtDNAs mutantes y contribuir a la comprensión de sus patologías asociadas y al desarrollo de nuevos tratamientos, beneficiando potencialmente a pacientes con diversas formas de enfermedades mitocondriales».