El receptor Ashwell-Morell ha sido un punto de interés en la investigación biomédica desde su identificación como el primer receptor celular aislado y una importante lectina en mamíferos. Aunque su función en el organismo ha eludido a los científicos durante más de 30 años, un estudio reciente ha proporcionado nuevos conocimientos sobre este receptor crucial, especialmente en el contexto de condiciones críticas como la sepsis.
En 2008, un equipo de investigadores en San Diego reveló que el receptor Ashwell-Morell desempeña un papel vital en la coagulación sanguínea y modula la respuesta del organismo ante la sepsis, una afección que causa más muertes que el cáncer anualmente. Jamey Marth, profesor en Sanford Burnham Prebys, subraya la importancia de este receptor en la regulación de la inflamación y la coagulación, afirmando que «no hay forma más rápida de alterar los niveles y funciones de los componentes en el torrente sanguíneo que modificar sus tasas de eliminación».
A pesar de estos hallazgos iniciales, la investigación sobre el receptor Ashwell-Morell se ha visto empañada por informes contradictorios sobre las características de sus ligandos en el torrente sanguíneo. Para desentrañar cómo este receptor mantiene niveles normales de proteínas y otros componentes en la sangre, era necesario identificar qué ligandos eran relevantes. Los resultados inconsistentes en estudios previos complicaron esta tarea.
Un enfoque innovador en la investigación
Consciente de que las limitaciones tecnológicas habían contribuido a las discrepancias en los hallazgos, Marth y su equipo adoptaron un nuevo enfoque en su estudio reciente, publicado en Proceedings of the National Academy of Sciences. Utilizando una técnica innovadora llamada glicoingeniería, los investigadores editaron los genes de las células responsables de la formación de glicanos, logrando así producir estructuras de glicanos casi homogéneas y discretas en diferentes formas de proteínas.
Este avance permitió al equipo estudiar las formas de glicosilación de la fosfatasa alcalina intestinal (IAP), un conocido ligando del receptor Ashwell-Morell. Gracias a esta metodología, lograron aclarar el efecto de cada uno de los enlaces de glicanos en la unión con el receptor. Según Marth, «sin la capacidad de diseñar formas de proteínas casi homogéneas, no hubiera sido posible llevar a cabo este experimento de manera adecuada».
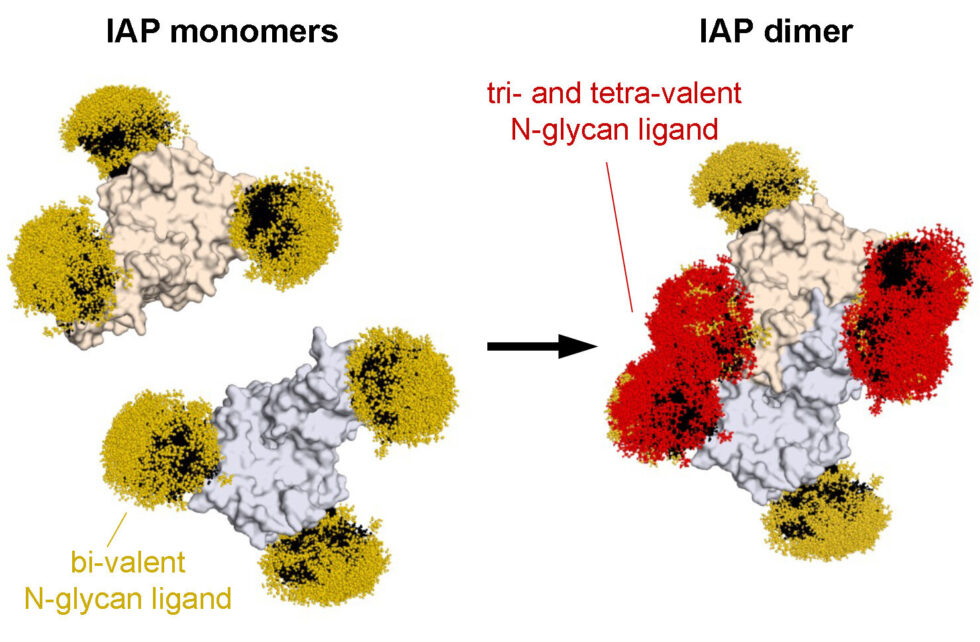
Los resultados del estudio indicaron una ausencia de ligandos del receptor Ashwell-Morell en formas de IAP que presentaban cadenas de glicanos biantennarias. Esta limitación sugiere que el grupo de ligandos potenciales para este receptor es bastante restringido, dado que la mayoría de las proteínas en circulación en la sangre están modificadas por cadenas de glicanos de este tipo. Sin embargo, la IAP sigue siendo un ligando esencial.
El equipo descubrió que, al dimerizarse, las estructuras de cadenas de azúcares biantennarias de la IAP se acercan lo suficiente como para imitar estructuras de glicanos tri y tetra-antennarias, necesarias para la unión con el receptor Ashwell-Morell. John Hintze, primer autor del estudio, explica que «a través del plegamiento proteico y la asamblea oligomérica, las cadenas de azúcar biantennarias más comunes pueden superponerse para crear ligandos viables, lo que explica cómo el receptor se une y elimina más de un tercio de todas las proteínas en el plasma sanguíneo».
Además de sus investigaciones sobre los efectos de estas decoraciones de cadenas de azúcares, Marth y sus colaboradores abordaron la confusión existente sobre la sialilación, una modificación que se produce cuando el ácido siálico se añade al final de las cadenas de glicanos. A través de su trabajo, demostraron que el receptor solo puede unirse a la IAP si se elimina la modificación de ácido siálico, ofreciendo explicaciones para los resultados contradictorios de investigaciones previas.
Marth planea continuar explorando el receptor Ashwell-Morell y otros receptores celulares similares para profundizar en cómo estos regulan el torrente sanguíneo y controlan el proteoma sanguíneo. En sus propias palabras, «es fundamental avanzar en la comprensión de qué controla la abundancia normal y, por ende, la función de las proteínas sanguíneas en circulación». Las alteraciones en estos niveles son criterios diagnósticos que los médicos utilizan para detectar y pronosticar enfermedades.