Un reciente estudio llevado a cabo por científicos chinos ha desvelado la compleja maquinaria molecular que impulsa el intercambio de energía en los cloroplastos, ofreciendo una visión esencial sobre un evento clave en la evolución de la vida vegetal. Dirigido por el investigador Fan Minrui del Centro de Excelencia en Ciencias Moleculares de Plantas de la Academia China de Ciencias, el trabajo aclara la estructura y función del translocador de ATP/ADP, un miembro crucial de la familia de proteínas transportadoras de nucleótidos (NTT, por sus siglas en inglés), que facilita la transferencia de energía a través de las membranas de los cloroplastos.
Los hallazgos fueron publicados de manera online en la revista Nature en un artículo titulado «Estructura y mecanismo del translocador de ATP/ADP de plastidios/parásitos» el 13 de marzo. Este estudio no solo profundiza en nuestra comprensión de la endosimbiosis de cloroplastos —el proceso mediante el cual bacterias antiguas se integraron en las células vegetales como cloroplastos—, sino que también abre posibles vías para mejorar los rendimientos de los cultivos y desarrollar nuevos fármacos para combatir patógenos intracelulares.
Los cloroplastos son esenciales para la producción de energía en las plantas, desempeñando un papel similar al de las mitocondrias (que son las centrales energéticas de las células animales). Sin embargo, mientras que las mitocondrias utilizan el translocador de ATP/ADP AAC para exportar ATP (la «moneda energética» de las células) al citoplasma e importar ADP para la síntesis de ATP, los cloroplastos emplean una proteína NTT para importar ATP del citoplasma, alimentando así la fotosíntesis, la síntesis de almidón y la síntesis de ácidos grasos. Es importante destacar que la proteína NTT en cloroplastos es altamente específica para ATP/ADP, a diferencia de algunas proteínas relacionadas en diatomeas que pueden transportar un rango más amplio de nucleótidos.
El origen del NTT en cloroplastos
Una cuestión que ha intrigado a los investigadores es el origen de la proteína NTT en cloroplastos. La teoría de la endosimbiosis sugiere que los cloroplastos evolucionaron a partir de cianobacterias. Sin embargo, las cianobacterias de vida libre carecen de proteínas NTT. Una hipótesis plantea que una célula eucariota ancestral engulló tanto una cianobacteria como una bacteria similar a Chlamydia. Se sugiere que la cianobacteria pudo haber adquirido una proteína NTT de Chlamydia a través de transferencia horizontal de genes (intercambio de genes entre organismos), dado que Chlamydia utiliza una proteína similar para robar ATP de las células huésped. Esta proteína se habría conservado durante la evolución del cloroplasto. El «parasitismo energético» exhibido por Chlamydia y la función única de esta proteína NTT han intrigado a los científicos durante años.
Para validar esta hipótesis, el grupo de investigación determinó las estructuras tridimensionales de las proteínas NTT de los cloroplastos de Arabidopsis y de Chlamydia pneumoniae con una resolución casi atómica (2.72–2.90 Å). Descubrieron que las proteínas NTT consisten en 12 hélices transmembrana, adoptando un pliegue típico de los transportadores de la superfamilia de los facilitadores mayores (MFS). Las estructuras revelaron que ambas proteínas comparten una arquitectura general similar a pesar de las diferencias específicas entre especies. Esto respalda la hipótesis de que la proteína NTT de los cloroplastos se originó a partir de un ancestro similar a Chlamydia.
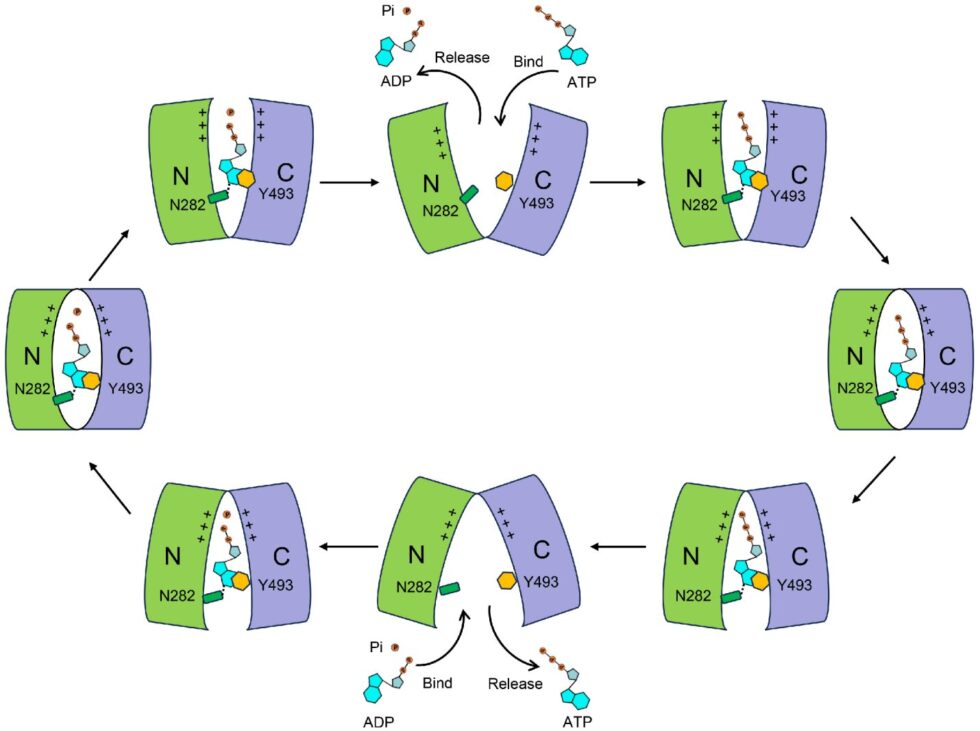
El estudio también identificó el sitio de unión de ATP (o ADP y Pi) dentro de la proteína NTT. La unión de ATP implica interacciones extensas entre sus tres partes (adenina, ribosa y fosfato) y la proteína NTT. La parte adenina de ATP se encuentra entre residuos de aminoácidos aromáticos e hidrofóbicos, mientras que sus grupos fosfato negativamente cargados interactúan con residuos de aminoácidos cargados positivamente en su entorno. El sitio de unión para ADP es similar al de ATP, pero presenta algunas diferencias conformacionales: los grupos fosfato de ATP adoptan una conformación extendida, mientras que los grupos fosfato de ADP están plegados, resultando en variaciones sutiles en los residuos interactuantes circundantes.
Curiosamente, la posición de unión para Pi coincide exactamente con la posición del grupo γ-fosfato de ATP. Para validar estos hallazgos estructurales, los investigadores realizaron experimentos de intercambio ATP/ADP basados en quimioluminiscencia, así como experimentos de captación de ATP-32P utilizando isótopos radiactivos.
Los investigadores también analizaron la estabilidad térmica de la proteína NTT y encontraron que Pi mejoró significativamente la unión de ADP, sugiriendo un efecto cooperativo entre ambos. Este hallazgo se alinea con las propiedades de co-transporte de ADP y Pi en la proteína NTT. Además, el estudio reveló que cuando un residuo de asparagina evolutivamente conservado (N282 en Arabidopsis AtNTT1) muta a alanina, la actividad de transporte hacia otros nucleótidos (como GTP, CTP y UTP) aumenta significativamente. Esto sugiere que este residuo puede desempeñar un papel crucial en el reconocimiento específico de ATP por parte de la proteína NTT.
Al comparar las estructuras de la proteína NTT en diferentes conformaciones y realizar experimentos de mutación y funcionales, el estudio demuestra que los dominios N-terminal y C-terminal de la proteína NTT son relativamente rígidos. Estos dominios se mueven entre sí y, al alterar sus interacciones, la proteína facilita la unión, el transporte transmembrana y la liberación de ATP o ADP más Pi. Este mecanismo de transporte se alinea con el modelo del «interruptor de péndulo» del MFS. En este modelo, los cambios conformacionales entre los dominios N-terminal y C-terminal permiten que la proteína abra y cierre alternativamente su vía de transporte, asegurando la unión y liberación eficiente del sustrato y facilitando su translocación a través de la membrana. Este mecanismo es crítico para la capacidad de la proteína NTT de llevar a cabo su papel en el intercambio ATP/ADP y el co-transporte de Pi.
Este estudio no solo desvela el mecanismo molecular del reconocimiento de sustratos y el transporte transmembrana por parte de la proteína NTT de cloroplastos y Chlamydia, sino que también profundiza nuestra comprensión del mecanismo de transferencia de energía transmembrana en la endosimbiosis de cloroplastos. Además, proporciona valiosos conocimientos sobre la ingeniería de proteínas NTT para mejorar los rendimientos de los cultivos y el diseño de inhibidores de proteínas NTT para tratar enfermedades causadas por patógenos intracelulares obligados.







