Investigadores de King’s College London y de la Universidad de Washington han descubierto una proteína bacteriana previamente desconocida que podría revolucionar la forma en que se administran los tratamientos contra el cáncer. Este hallazgo, publicado en la revista Proceedings of the National Academy of Sciences, se centra en una proteína a la que se le ha dado el nombre de BeeR, que presenta una estructura tridimensional única y podría ser clave para el diseño de sistemas de entrega de fármacos dirigidos a los tumores.
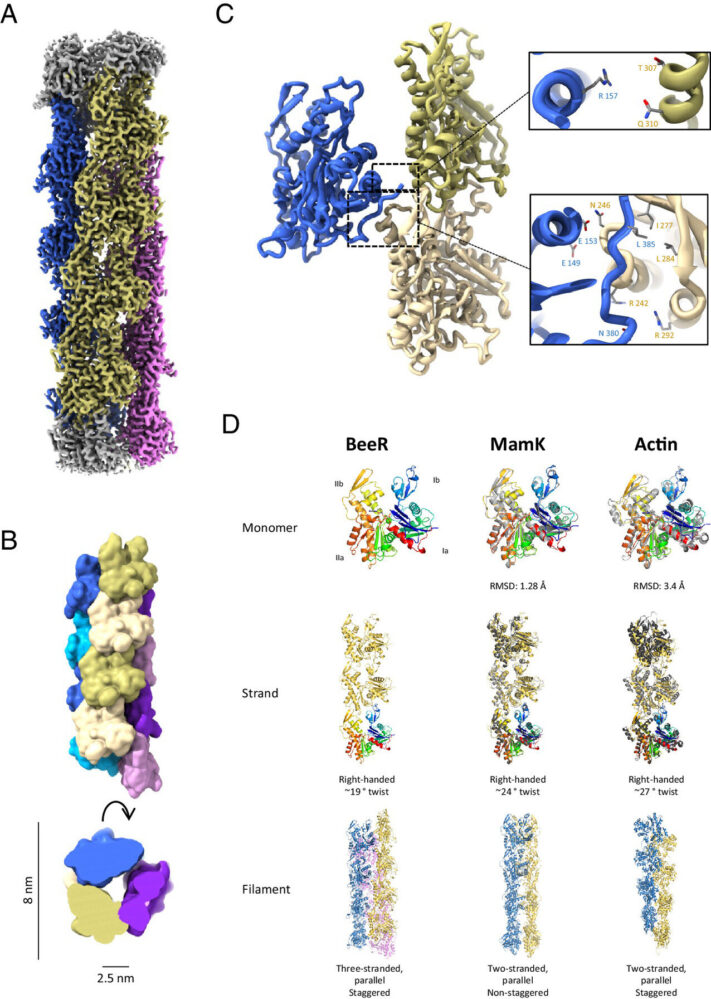
La proteína BeeR pertenece a una familia de bacterias que se encuentran tanto en el suelo como en el microbioma humano. Su función es similar a la del actina, la proteína más abundante en las células humanas. En presencia de una sustancia química llamada ATP, las moléculas de actina se ensamblan en largas cadenas helicoidales conocidas como filamentos, que desempeñan funciones vitales, como la conservación de la forma celular y la división celular. Sin embargo, el equipo de investigadores ha observado que BeeR presenta una notable diferencia estructural en comparación con otros proteínas similares a la actina.
Estructura y potencial de la proteína BeeR
El Dr. Julien Bergeron, investigador principal en el Randall Center for Cell & Molecular Biophysics de King’s College London, explicó que, a través de datos metagenómicos—es decir, secuenciación extensa de genomas bacterianos—se identificó esta proteína actin-like en una familia de bacterias conocida como Verrucomicrobiota. Mediante el uso de microscopios criogénicos electrónicos de última generación, lograron determinar la estructura atómica de la proteína, mostrando que, en lugar de formar un filamento, BeeR se organiza en un tubo rígido con un vacío en su interior, característica que no se había observado en otras proteínas similares.
El descubrimiento de BeeR se produjo cuando el Dr. Bergeron era investigador postdoctoral en la Universidad de Washington, en el laboratorio del profesor Justin Kollman. Sin embargo, en ese momento no pudieron resolver la estructura de la proteína. Tras trasladarse a King’s College y aplicar técnicas avanzadas de imagenología, el equipo liderado por Bergeron pudo demostrar que, en presencia de ATP, BeeR se ensambla en tres hebras que forman esta estructura tubular hueca.
El Dr. Bergeron subrayó que, aunque actualmente se desconoce la función exacta de BeeR, la identificación de esta proteína que forma una estructura tubular transforma la comprensión sobre la evolución de las proteínas de este tipo. A través de su empresa emergente Prosemble, el Dr. Bergeron está trabajando para aprovechar la singular estructura de los tubos de BeeR con el fin de crear nanopartículas proteicas que permitan la entrega específica de fármacos anticancerosos a los sitios tumorales. El equipo ya está testeando este enfoque en modelos preclínicos de cáncer de mama.
Las estructuras de BeeR no solo son tubulares, sino que además cuentan con una cavidad central lo suficientemente grande como para albergar moléculas de fármacos. La capacidad de controlar fácilmente el ensamblaje y desensamblaje de estos tubos mediante el ATP proporciona un método sencillo para la entrega y liberación de medicamentos en el lugar deseado, lo que podría marcar un antes y un después en la administración de tratamientos contra el cáncer.
Más información:
Julien R. C. Bergeron et al, A family of bacterial actin homologs forms a three-stranded tubular structure, Proceedings of the National Academy of Sciences (2025). DOI: 10.1073/pnas.2500913122, www.pnas.org/doi/10.1073/pnas.2500913122