El descubrimiento de fármacos ha sido históricamente un proceso costoso y prolongado, donde las cálculos de energía libre de unión entre el potencial compuesto farmacológico y su objetivo son cruciales para reducir los costos y agilizar el proceso. En este contexto, surge PairMap, un enfoque computacional diseñado para superar los desafíos de la predicción de la unión entre moléculas.
Los investigadores se enfrentan a la difícil tarea de predecir cuán fuertemente un potencial fármaco se unirá a su diana, lo que ha generado una alta demanda de métodos computacionales que puedan diseñar compuestos que se unan de manera efectiva. Sin embargo, los métodos tradicionales para calcular la energía de unión libre enfrentan dificultades significativas cuando se trata de grandes transformaciones químicas o reordenamientos moleculares importantes.
Innovación en el Cálculo de Energía de Unión
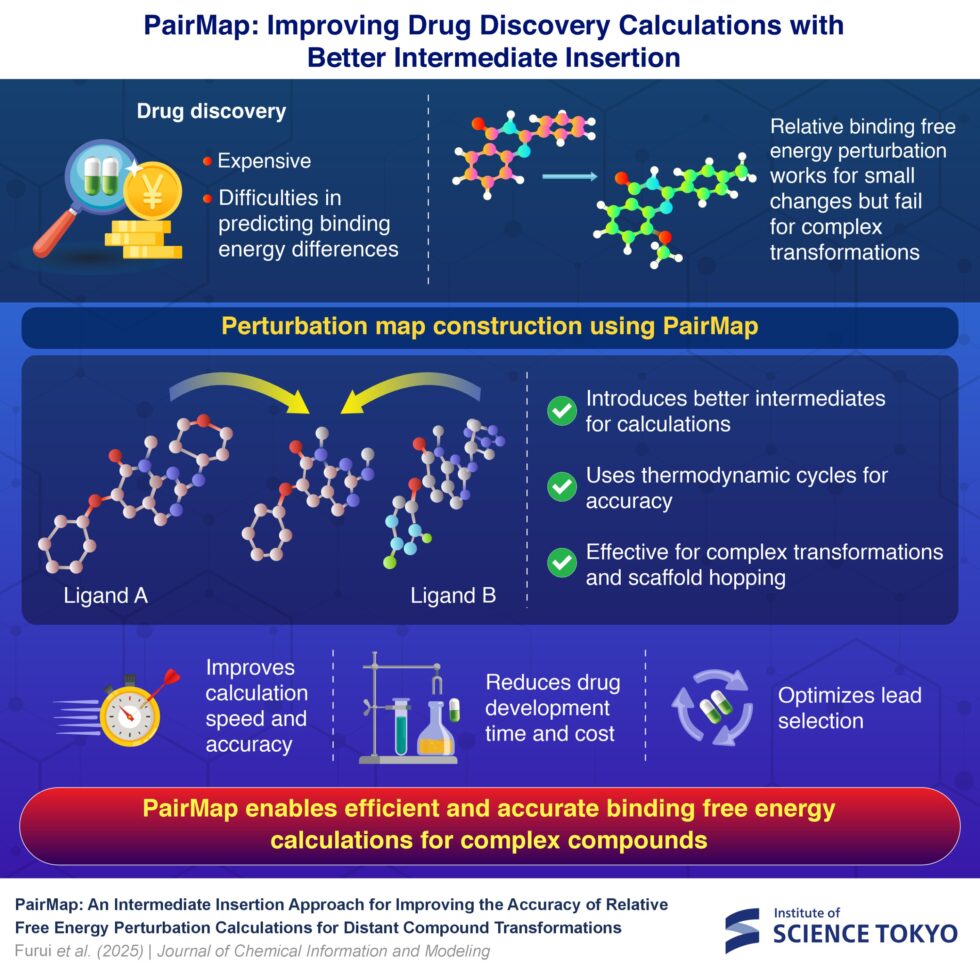
PairMap se presenta como una solución a estas limitaciones. Utiliza cálculos de perturbación de energía libre de unión relativa (RBFEP), que han sido empleados durante mucho tiempo para predecir las afinidades de unión de compuestos químicamente similares. Aunque estos cálculos son eficaces para pequeños cambios estructurales, su precisión disminuye ante transformaciones más complejas, lo que resulta en altos márgenes de error y eficiencias computacionales limitadas.
El enfoque de PairMap consiste en introducir sistemáticamente compuestos intermedios para crear un camino paso a paso entre las dos moléculas en cuestión. Este método novedoso minimiza los errores de cálculo, mejora la convergencia y reduce los costos computacionales. Esta investigación es fruto de una colaboración entre el Profesor Asociado Masahito Ohue del Instituto de Ciencia de Tokio y Alivexis, Inc., y ha sido publicada en el Journal of Chemical Information and Modeling el 12 de enero de 2025.
Ohue destaca: «PairMap tiene el potencial de redefinir el descubrimiento de fármacos. Al incorporar intermedios bien construidos y ciclos termodinámicos, hemos alcanzado un nivel de precisión sin precedentes en nuestras predicciones de energía».
En su estudio, el equipo utilizó dos ligandos, denominados «A» y «B». Generaron intermedios posibles que podrían surgir en la reacción entre estos ligandos y determinaron el camino óptimo que podría resultar en una unión efectiva. Posteriormente, construyeron un mapa de perturbación, que revela la energía libre de unión entre A y B.
A través de una evaluación exhaustiva utilizando conjuntos de datos de referencia, PairMap demostró su superioridad frente a los métodos convencionales, reduciendo el error absoluto medio en las predicciones de energía de unión de 1.70 kcal/mol a 0.93 kcal/mol. Para transformaciones complejas, PairMap alcanzó una precisión excepcional en comparación con enfoques existentes, alineándose estrechamente con datos experimentales y validando así las aplicaciones prácticas de la herramienta.
Lo que distingue a PairMap es su enfoque integral para la generación de intermedios. A diferencia de los métodos tradicionales, que utilizan un enfoque basado en umbrales para introducir intermedios, PairMap explora exhaustivamente todos los intermedios potenciales y identifica el camino de conversión óptimo. Además, incorpora ciclos termodinámicos en sus cálculos, asegurando una alta precisión mediante la corrección de errores basada en la conservación de la energía.
Ohue resalta las implicaciones más amplias de este enfoque, afirmando: «Al abordar las transformaciones químicas más complejas con una sobrecarga computacional mínima, PairMap empodera a los investigadores para explorar espacios químicos previamente considerados demasiado desafiantes».
Más allá de sus logros actuales, PairMap ofrece posibilidades emocionantes para el futuro del diseño computacional de fármacos. Facilita la creación de medicamentos más efectivos y específicos, lo que podría acelerar el descubrimiento de tratamientos para enfermedades que carecen de terapias eficaces. La flexibilidad de la herramienta permite una integración fluida en los flujos de trabajo existentes de descubrimiento de fármacos, reduciendo así los costos y el tiempo de comercialización de nuevos medicamentos.
Los desarrollos futuros buscan ampliar su aplicación a casos que involucren intermedios con cambios de carga significativos. Al hacer accesible esta herramienta, tanto el Profesor Ohue como sus colaboradores en Alivexis, Inc. esperan catalizar una nueva era de innovación en el descubrimiento de fármacos.







