Investigadores de la Universidad de Salud y Ciencias de Oregón, en colaboración con la Universidad Estatal de Oregón, han desvelado la organización estructural y los componentes proteicos de un complejo de transferencia de lípidos conocido como LPD-3. Este hallazgo sugiere un posible mecanismo para el movimiento a gran escala de lípidos entre las membranas celulares, un proceso crucial para el funcionamiento celular.
Las células deben gestionar constantemente la estructura y composición de sus membranas, las cuales dependen en gran medida de los lípidos producidos en el retículo endoplásmico. Debido a su naturaleza hidrofóbica, estos lípidos no pueden fluir libremente por el citoplasma. Se ha demostrado que las proteínas de transporte de lípidos son capaces de movilizar pequeñas cantidades de lípidos entre compartimentos celulares. Un grupo distintivo, conocido como proteínas de transporte de lípidos tipo puente (BLTPs), podría facilitar la transferencia masiva de lípidos al formar estructuras alargadas y similares a túneles que conectan diferentes orgánulos. No obstante, el análisis estructural de estas proteínas ha sido limitado debido a su tamaño y complejidad bioquímica.
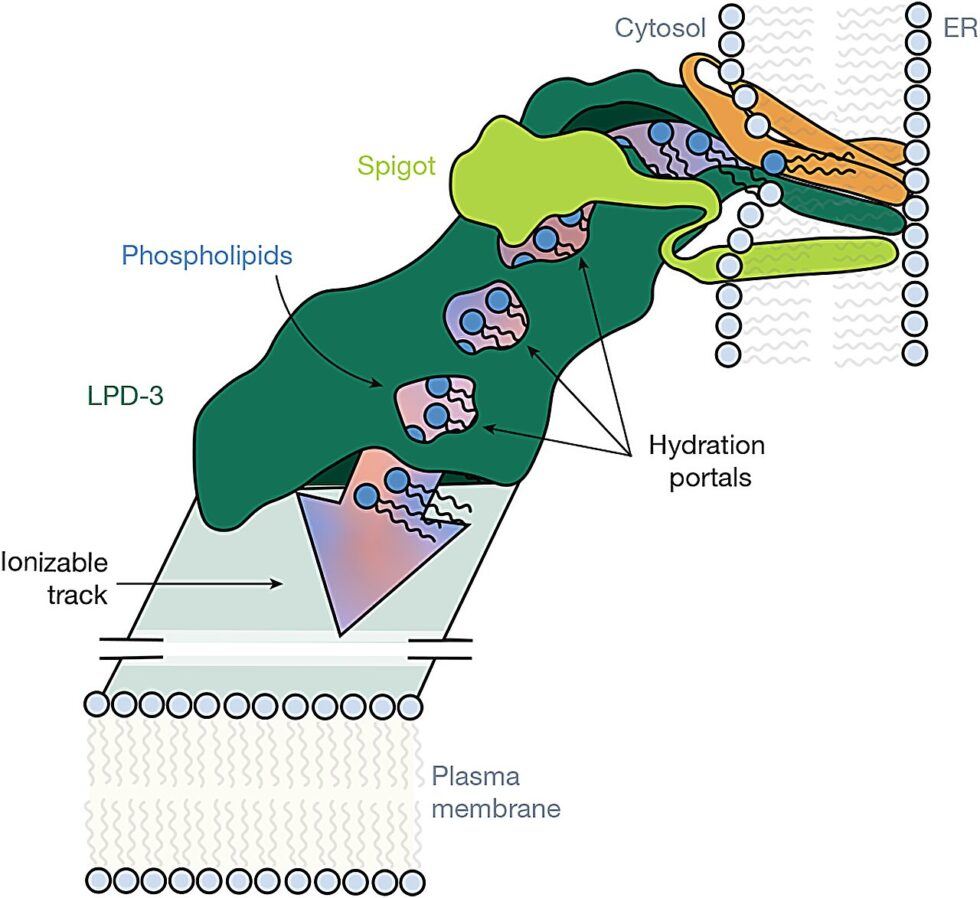
Estructura del complejo LPD-3
En el estudio titulado «Base estructural de la transferencia de lípidos por una proteína de transferencia de lípidos tipo puente», publicado en Nature, los investigadores emplearon microscopía electrónica criogénica y espectrometría de masas en el LPD-3 nativo aislado de Caenorhabditis elegans. Este análisis permitió revelar la composición de subunidades y los detalles estructurales del complejo.
Los científicos diseñaron dos cepas de C. elegans con etiquetas fluorescentes y de epítopos colocadas en cada extremo del gen endógeno lpd-3. La cepa etiquetada en el extremo C-terminal, que mantuvo fenotipos de desarrollo y de estrés por frío normales, fue utilizada para aislar el complejo nativo LPD-3. Para generar material suficiente para el análisis estructural y bioquímico, se purificaron proteínas de aproximadamente 60 millones de gusanos, utilizando cromatografía de exclusión por tamaño basada en fluorescencia.
El análisis estructural mediante microscopía electrónica criogénica permitió generar un mapa completo de la proteína a una resolución de 6.2 angstroms. Sin embargo, la resolución de la mitad C-terminal se vio limitada debido a la heterogeneidad estructural. LPD-3 se resolvió como una estructura alargada en forma de túnel de 345 angstroms, con un interior hidrofóbico repleto de 27 moléculas de lípidos y tres fosfolípidos adicionales en su dominio transmembrana. Residuos ácidos y básicos alternados recubren el túnel, formando una pista ionizable que se extiende a lo largo de toda su longitud.
La espectrometría de masas identificó dos proteínas auxiliares que se purificaron junto con LPD-3. Una, denominada Spigot, se une a la región N-terminal de LPD-3 y presenta características conservadas en diversas especies. La segunda, referida como proteína auxiliar de transferencia de lípidos 2 (LTAP2), mostró conservación, aunque no pudo ser localizada con precisión en el modelo estructural. También se observó un tercer componente proteico en forma de un haz transmembrana de tres hélices, cuya identidad y función aún no se han esclarecido.
El silenciamiento por interferencia de ARN del gen spgt-1 en C. elegans resultó en una reducción del 79.1% en la fluorescencia del actina apical, mientras que el silenciamiento de lpd-3 llevó a una reducción del 91.6%. El silenciamiento de los ortólogos de Spigot en Drosophila interrumpió la fagocitosis en astrocitos. En células HeLa, el silenciamiento de C1orf43, el ortólogo humano de Spigot, afectó la formación de sitios de contacto entre el retículo endoplásmico y la membrana plasmática.
Los resultados establecen la composición subunitaria y la arquitectura molecular del complejo LPD-3, así como la interacción de las moléculas de lípidos con las superficies internas del túnel durante el transporte. Los residuos ionizables y los puertos de hidratación organizan los grupos cabeza de lípido a lo largo de una pista interna continua, lo que sugiere un mecanismo estructural para la transferencia masiva de lípidos.
Estos hallazgos confirman que Spigot es un componente conservado del complejo en múltiples especies y desempeña un papel en el transporte de fosfolípidos y la organización celular. Los silenciamientos de ortólogos de Spigot en gusanos, moscas y células humanas produjeron interrupciones consistentes en funciones relacionadas con la membrana. La estructura revelada de LPD-3 proporciona una base para futuras investigaciones sobre enfermedades relacionadas con BLTP1.
Las mutaciones en el BLTP1 humano están asociadas con el síndrome de Alkuraya-Kučinskas, un trastorno neurológico grave. Las perspectivas estructurales de este estudio ofrecen fundamentos para estudios futuros sobre mecanismos de la enfermedad y posibles estrategias terapéuticas.







