Investigadores de la Universidad de Stanford han realizado un avance significativo en la comprensión de los mecanismos que permiten a las enzimas acelerar las reacciones bioquímicas de manera extraordinaria. A través de un estudio que utiliza más de 1,000 imágenes de rayos X, han desentrañado uno de los grandes misterios de la vida: cómo estas moléculas actúan como catalizadores en una variedad de procesos biológicos esenciales. Este descubrimiento no solo tiene implicaciones para la biología básica, sino que también podría transformar campos como el desarrollo de fármacos y la enseñanza de la ciencia en las aulas.
El autor principal del estudio, Dan Herschlag, profesor de bioquímica, destacó la magnitud del fenómeno: «Cuando digo que las enzimas aceleran las reacciones, me refiero a que algunas lo hacen hasta un billón de billones de veces más rápido». A pesar de su importancia, la comprensión exacta de cómo funcionan estas «pequeñas máquinas» ha sido limitada. A lo largo del tiempo, los bioquímicos han formado ideas y teorías, pero no han logrado traducirlas en un entendimiento específico de las interacciones químicas y físicas que permiten estas tasas de reacción tan elevadas.
Un nuevo modelo de comprensión
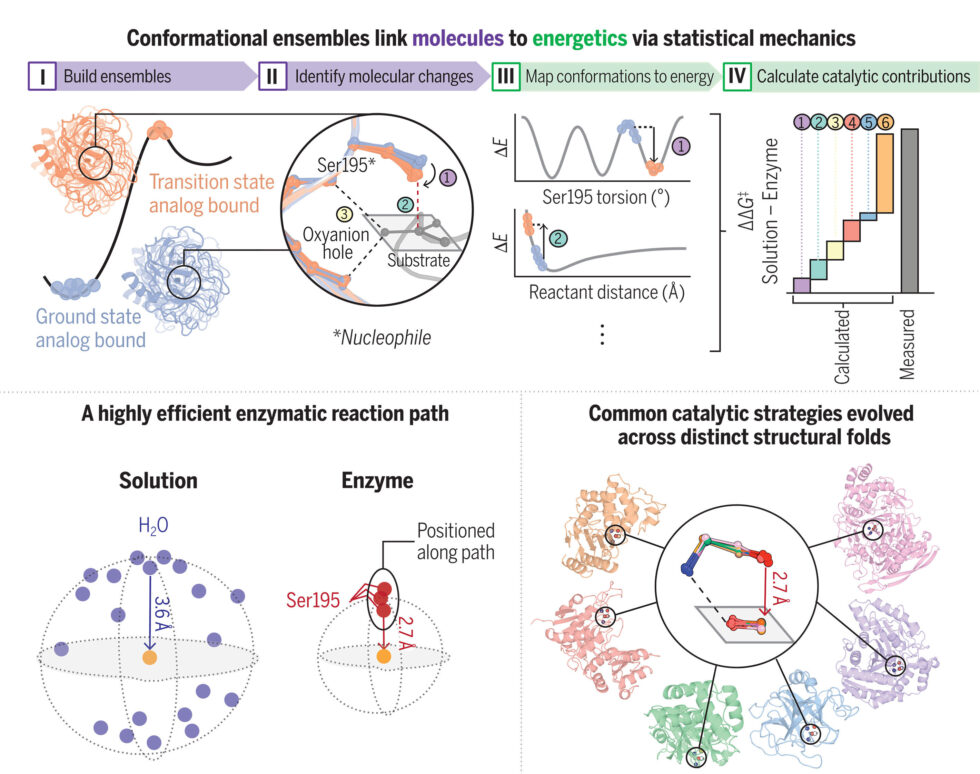
El estudio, publicado en la revista Science, propone un enfoque innovador basado en lo que se denomina «conjuntos de conformaciones». Herschlag y su colega, Siyuan Du, argumentan que las enzimas no son estructuras fijas, sino que existen en un estado dinámico que les permite moverse entre diferentes conformaciones durante el proceso de catálisis. Este enfoque ha permitido a los investigadores cuantificar y explicar detalladamente cuáles son las características de las enzimas que contribuyen a su capacidad catalítica.
La investigación se centró en las proteasas de serina, un grupo de enzimas utilizado comúnmente en la enseñanza de la bioquímica. Al estudiar cómo se comportan estas enzimas, Herschlag y Du desglosaron la catálisis en sus componentes energéticos individuales, enfocándose en el sitio activo donde la enzima interactúa con la molécula objetivo. A través de este análisis, han podido identificar estrategias catalíticas que se repiten en más de 100 enzimas diferentes, sugiriendo que estos mecanismos han sido evolutivamente seleccionados en múltiples familias en la naturaleza.
Una de las observaciones clave del estudio es la forma en que los átomos en el sitio activo de la enzima generan tensión al acercarse a la molécula que están atacando, lo que permite que la reacción avance con mayor rapidez. Du comparó este fenómeno con un resorte comprimido, aunque advirtió que el movimiento de átomos individuales es más complejo que un simple rebote. Este hallazgo no solo proporciona una explicación más clara de cómo funcionan las enzimas, sino que también abre la puerta a la posibilidad de diseñar nuevas enzimas que imiten estas estrategias naturales.
Los investigadores subrayan que, para poder aprovechar plenamente estas capacidades, es fundamental profundizar en el entendimiento de las enzimas. Herschlag concluyó que «necesitamos comprender mejor las enzimas antes de poder esperar tener un control real sobre ellas y diseñar versiones más eficientes». Este avance no solo promete revolucionar la bioquímica, sino que también podría tener un impacto duradero en la educación científica, reformulando cómo se enseña esta disciplina en las instituciones educativas.