Investigadores del Instituto de Ciencias de la Vida a Nanoescala (WPI-NanoLSI) de la Universidad de Kanazawa han logrado un avance significativo en la comprensión del empaquetamiento del ADN en los espermatozoides. Gracias a la utilización de la microscopía de fuerza atómica de alta velocidad (HS-AFM), han capturado el proceso en tiempo real de la condensación del ADN inducida por las protaminas (PRM). Este descubrimiento proporciona información crucial sobre la fertilidad, la estabilidad del genoma y posibles aplicaciones futuras en medicina, tal como se detalla en un estudio publicado en la revista Nucleic Acids Research.
En la mayoría de las células, el ADN se enrolla alrededor de proteínas llamadas histonas, lo que permite que esté empaquetado de forma laxa y accesible para la actividad genética. Sin embargo, en los espermatozoides, las histonas son reemplazadas por protaminas, que permiten una condensación extrema del ADN. Esta compactación es esencial para proteger el material genético durante la fertilización, garantizar el transporte eficiente del ADN al óvulo y contribuir al desarrollo del embrión.
Un nuevo modelo para la condensación del ADN
A pesar de su importancia, los pasos precisos de cómo las protaminas condensan el ADN en estructuras altamente estables han permanecido en gran medida desconocidos. Anteriores métodos de imagen solo podían capturar instantáneas estáticas, dejando muchas preguntas sin respuesta. Ahora, por primera vez, Richard W. Wong y su equipo han utilizado imágenes en tiempo real para revelar todo el proceso de condensación.
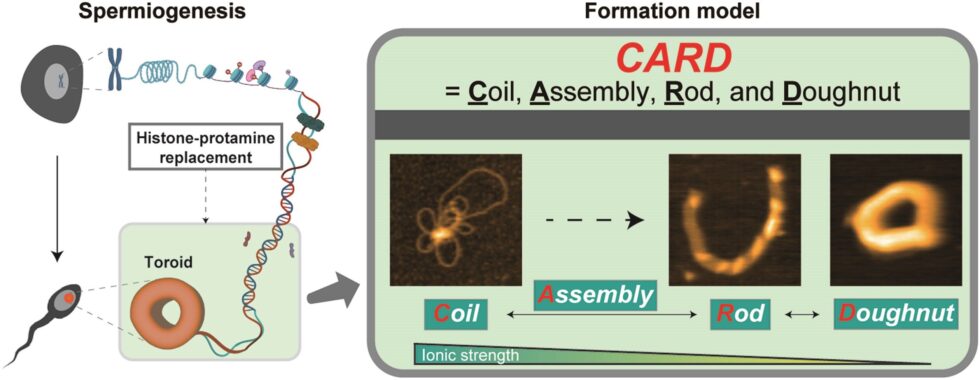
Utilizando HS-AFM, el equipo de investigación visualizó directamente la transformación paso a paso de las estructuras del ADN a medida que se unen a las protaminas. El estudio presenta un nuevo modelo denominado CARD (Coil-Assembly-Rod-Doughnut), que describe el proceso de condensación a través de cuatro etapas distintas: la Etapa de Bobina, donde el ADN forma bucles sueltos; la Etapa de Ensamblaje, donde las protaminas se unen, aumentando la organización estructural; la Etapa de Varilla, donde el ADN se compacta aún más; y la Etapa de Donut (Toroide), donde se forma la estructura final estable.
Además, los investigadores descubrieron que este empaquetamiento es reversible, lo que significa que la estructura puede cambiar en función de las condiciones ambientales. Estos hallazgos tienen implicaciones importantes para comprender la infertilidad masculina, la biología de la cromatina y la terapia génica.
La investigación sobre fertilidad podría beneficiarse de los conocimientos adquiridos sobre el empaquetamiento del ADN, ayudando a diagnosticar y tratar la infertilidad masculina. La terapia génica podría mejorar a través de una comprensión más profunda de la compactación del ADN y su papel en la entrega de material genético en tratamientos médicos.
Los hallazgos también podrían ser aprovechados por la biología sintética y la nanotecnología para desarrollar nuevos métodos de manipulación de estructuras de ADN en aplicaciones biotecnológicas. «Nuestros hallazgos proporcionan una visión dinámica de cómo las protaminas dan forma a la estructura de la cromatina espermática, un proceso esencial para la fertilidad y la estabilidad del genoma», afirma Wong. «Esta investigación no solo mejora nuestra comprensión de la reproducción, sino que también tiene implicaciones de gran alcance para la genética y los tratamientos de fertilidad.»
Para más información, se puede consultar el estudio completo: Goro Nishide et al., «Spatiotemporal dynamics of protamine–DNA condensation revealed by high-speed atomic force microscopy», Nucleic Acids Research (2025). DOI: 10.1093/nar/gkaf152.